Effektiviteten hos en värmemaskin. Effektiviteten hos en värmemotor. Ämnen för kodifieraren för Unified State Examination: principer för drift av värmemotorer, effektivitet hos en värmemotor, värmemotorer och miljöskydd
Driften av många typer av maskiner kännetecknas av en så viktig indikator som värmemotorns effektivitet. Varje år strävar ingenjörer efter att skapa mer avancerad teknik, som med mindre skulle ge maximalt resultat av dess användning.
Värmemotoranordning
Innan du förstår vad det är, är det nödvändigt att förstå hur denna mekanism fungerar. Utan att känna till principerna för dess åtgärd är det omöjligt att ta reda på kärnan i denna indikator. En värmemotor är en enhet som utför arbete med intern energi. Varje värmemotor som förvandlas till en mekanisk en använder termisk expansion av ämnen när temperaturen ökar. I solid-state motorer är det möjligt att inte bara ändra volymen av ett ämne, utan också formen på kroppen. Verkan hos en sådan motor är föremål för termodynamikens lagar.
Funktionsprincip
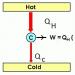
För att förstå hur en värmemotor fungerar är det nödvändigt att överväga grunderna i dess design. För driften av enheten behövs två kroppar: varm (värmare) och kall (kylskåp, kylare). Funktionsprincipen för värmemotorer (värmemotoreffektivitet) beror på deras typ. Ofta är kylskåpet en ångkondensor, och värmaren är vilken typ av bränsle som helst som brinner i eldstaden. Effektiviteten hos en ideal värmemotor hittas av följande formel:
Effektivitet = (Theat - Cool) / Theat. x 100 %.
I det här fallet kan verkningsgraden för en riktig motor aldrig överstiga värdet som erhålls enligt denna formel. Dessutom kommer denna siffra aldrig att överstiga det ovan nämnda värdet. För att öka effektiviteten höjs oftast värmarens temperatur och kylskåpstemperaturen sänks. Båda dessa processer kommer att begränsas av utrustningens faktiska driftsförhållanden.

När en värmemotor går utförs arbetet, eftersom gasen börjar tappa energi och svalnar till en viss temperatur. Den senare är vanligtvis flera grader högre än den omgivande atmosfären. Detta är temperaturen i kylskåpet. Denna speciella enhet är utformad för kylning och efterföljande kondensering av avgasånga. Där det finns kondensorer är temperaturen i kylskåpet ibland lägre än den omgivande temperaturen.
I en värmemotor, när en kropp värms upp och expanderar, kan den inte ge upp all sin inre energi för att utföra arbete. En del av värmen kommer att överföras till kylen tillsammans med eller ånga. Denna del av värmen går oundvikligen förlorad. Under bränsleförbränning får arbetsvätskan en viss mängd värme Q 1 från värmaren. Samtidigt utför den fortfarande arbete A, under vilken den överför en del av värmeenergin till kylskåpet: Q 2 Verkningsgrad kännetecknar motorns effektivitet inom området energiomvandling och transmission. Denna indikator mäts ofta i procent. Effektivitetsformel: η*A/Qx100 %, där Q är den energi som förbrukas, A är det nyttiga arbetet. Baserat på lagen om bevarande av energi kan vi dra slutsatsen att effektiviteten alltid kommer att vara mindre än enhet. Det kommer med andra ord aldrig att bli mer nyttigt arbete än den energi som lagts på det. Motoreffektivitet är förhållandet mellan nyttigt arbete och energin som tillförs av värmaren. Det kan representeras i form av följande formel: η = (Q 1 - Q 2)/ Q 1, där Q 1 är värmen som tas emot från värmaren och Q 2 ges till kylskåpet. Arbetet som utförs av en värmemotor beräknas med följande formel: A = |Q H | - |Q X |, där A är arbete, Q H är mängden värme som tas emot från värmaren, Q X är mängden värme som ges till kylaren. |Q H | - |Q X |)/|Q H | = 1 - |Q X |/|Q H | Det är lika med förhållandet mellan det arbete som utförs av motorn och mängden värme som tas emot. En del av den termiska energin går förlorad under denna överföring. Den maximala verkningsgraden för en värmemotor observeras i Carnot-enheten. Detta beror på det faktum att det i detta system endast beror på den absoluta temperaturen hos värmaren (Tn) och kylaren (Tx). Verkningsgraden för en värmemotor som körs på bestäms av följande formel: (Tn - Tx)/ Tn = - Tx - Tn. Termodynamikens lagar gjorde det möjligt att beräkna den maximala verkningsgraden som är möjlig. Denna indikator beräknades först av den franske vetenskapsmannen och ingenjören Sadi Carnot. Han uppfann en värmemotor som fungerade på en idealisk gas. Det fungerar i en cykel med 2 isotermer och 2 adiabater. Principen för dess funktion är ganska enkel: en värmekontakt förs till ett kärl med gas, vilket resulterar i att arbetsvätskan expanderar isotermiskt. Samtidigt fungerar den och tar emot en viss mängd värme. Därefter värmeisoleras kärlet. Trots detta fortsätter gasen att expandera, men adiabatiskt (utan värmeväxling med omgivningen). Vid denna tidpunkt sjunker dess temperatur till den i ett kylskåp. I detta ögonblick kommer gasen i kontakt med kylskåpet, som ett resultat av vilket den avger en viss mängd värme under isometrisk kompression. Därefter värmeisoleras kärlet igen. I detta fall komprimeras gasen adiabatiskt till sin ursprungliga volym och tillstånd. Nuförtiden finns det många typer av värmemotorer som arbetar på olika principer och på olika bränslen. De har alla sin egen effektivitet. Dessa inkluderar följande: En förbränningsmotor (kolv), som är en mekanism där en del av den kemiska energin i förbränning av bränsle omvandlas till mekanisk energi. Sådana anordningar kan vara gas eller vätska. Det finns 2-takts och 4-taktsmotorer. De kan ha en kontinuerlig arbetscykel. Enligt metoden för att förbereda bränsleblandningen är sådana motorer förgasare (med extern blandningsbildning) och diesel (med intern). Baserat på typen av energiomvandlare är de uppdelade i kolv, jet, turbin och kombinerad. Effektiviteten hos sådana maskiner överstiger inte 0,5. En Stirlingmotor är en anordning där arbetsvätskan är placerad i ett begränsat utrymme. Det är en typ av extern förbränningsmotor. Principen för dess funktion är baserad på periodisk kylning/uppvärmning av kroppen med produktion av energi på grund av förändringar i dess volym. Detta är en av de mest effektiva motorerna. Turbinmotor (roterande) med extern förbränning av bränsle. Sådana installationer finns oftast vid värmekraftverk. Turbiner (roterande) förbränningsmotorer används vid termiska kraftverk i toppläge. Inte lika utbredd som andra. En turbinmotor genererar en del av sin dragkraft genom sin propeller. Resten får den från avgaser. Dess design är en roterande motor på vars axel en propeller är monterad. Raket, turbojet och de som får dragkraft på grund av returen av avgaser. Solid state-motorer använder fast material som bränsle. Under drift är det inte dess volym som förändras, utan dess form. Vid drift av utrustningen används en extremt liten temperaturskillnad. Är det möjligt att öka effektiviteten hos en värmemotor? Svaret måste sökas inom termodynamiken. Hon studerar de ömsesidiga omvandlingarna av olika typer av energi. Det har konstaterats att alla tillgängliga mekaniska etc. inte kan användas samtidigt, omvandlingen till termisk sker utan några begränsningar. Detta är möjligt på grund av det faktum att den termiska energins natur är baserad på den oordnade (kaotiska) rörelsen av partiklar. Ju mer en kropp värms upp, desto snabbare kommer dess ingående molekyler att röra sig. Rörelsen av partiklar kommer att bli ännu mer oberäknelig. Tillsammans med detta vet alla att ordning lätt kan förvandlas till kaos, vilket är mycket svårt att beställa. Kort sagt, värmemotorer omvandla värme till arbete eller, omvänt, arbete till värme. 1. Värmemotorer omvandla värme som kommer från en extern källa till mekaniskt arbete. 2. Kylmaskineröverföra värme från en mindre uppvärmd kropp till en mer uppvärmd på grund av det mekaniska arbetet av en extern källa. Låt oss överväga dessa typer av värmemotorer mer i detalj. Vi vet att arbete på en kropp är ett av sätten att förändra dess inre energi: det arbete som utförs verkar lösas upp i kroppen och förvandlas till energin av slumpmässig rörelse och interaktion mellan dess partiklar. Ris. 1. Värm motor En värmemotor är en anordning som tvärtom utvinner användbart arbete från kroppens "kaotiska" inre energi. Uppfinningen av värmemotorn förändrade radikalt den mänskliga civilisationens ansikte. Det schematiska diagrammet för en värmemotor kan avbildas enligt följande (fig. 1). Låt oss ta reda på vad elementen i detta diagram betyder. Arbetsvätska motorn är gas. Den expanderar, flyttar kolven och utför därigenom användbart mekaniskt arbete. Men för att tvinga gasen att expandera och övervinna yttre krafter är det nödvändigt att värma den till en temperatur som är betydligt högre än omgivningstemperaturen. För att göra detta bringas gasen i kontakt med värmare- förbränning av bränsle. Vid förbränning av bränsle frigörs betydande energi, varav en del används för att värma gasen. Gasen får en mängd värme från värmaren. Det är på grund av denna värme som motorn utför användbart arbete. Allt detta är klart. Vad är ett kylskåp och varför behövs det? Med en enda gasexpansion kan vi använda den inkommande värmen så effektivt som möjligt och omvandla den helt till arbete. För att göra detta måste vi expandera gasen isotermiskt: termodynamikens första lag, som vi vet, ger oss i det här fallet. Men ingen behöver en engångsexpansion. Motorn måste vara igång cykliskt, vilket säkerställer periodisk repeterbarhet av kolvrörelserna. Därför, efter att expansionen är klar, måste gasen komprimeras och återställa den till sitt ursprungliga tillstånd. Under expansionsprocessen gör gasen ett positivt arbete. Under kompressionsprocessen utförs positivt arbete på gasen (och gasen i sig gör negativt arbete). Som ett resultat är det användbara arbetet med gas per cykel: . Naturligtvis ska det finnas class="tex" alt="A>0">
, или (иначе никакого смысла в двигателе нет).!} När vi komprimerar en gas måste vi göra mindre arbete än gasen gjorde under expansionen. Hur uppnår man detta? Svar: komprimera gasen under lägre tryck än under expansion. Med andra ord, på -diagrammet bör komprimeringsprocessen fortsätta nedan expansionsprocessen, dvs cykeln måste gå igenom medurs(Fig. 2). Ris. 2. Värm upp motorcykeln Till exempel, i cykeln i figuren, är det arbete som utförs av gasen under expansionen lika med arean av den krökta trapetsen. På samma sätt är det arbete som utförs av en gas under kompression lika med arean av en krökt trapets med ett minustecken. Som ett resultat visar sig arbetet som utförs av gasen per cykel vara positivt och lika med cykelns yta. Okej, men hur tvingar man gasen att återgå till sitt ursprungliga tillstånd längs en lägre kurva, det vill säga genom tillstånd med lägre tryck? Låt oss komma ihåg att för en given volym, ju lägre temperatur, desto lägre gastryck. När gasen komprimeras måste den därför gå igenom tillstånd med lägre temperaturer. Det är precis vad ett kylskåp är till för: att sval gas under komprimering. Kylaren kan vara atmosfären (för förbränningsmotorer) eller kylande rinnande vatten (för ångturbiner). När den kyls avger gasen lite värme till kylskåpet. Den totala mängden värme som tas emot av gasen per cykel är lika med . Enligt termodynamikens första lag: var är förändringen i gasens inre energi per cykel. Det är lika med noll: eftersom gasen har återgått till sitt ursprungliga tillstånd (och den inre energin, som vi minns, är statlig funktion). Som ett resultat är gasarbetet per cykel lika med: (1)
Som du kan se är det inte möjligt att helt omvandla värmen som kommer från värmaren till arbete. En del av värmen måste ges till kylskåpet för att säkerställa processens cykliska karaktär. En indikator på effektiviteten av att omvandla energin från förbränning av bränsle till mekaniskt arbete är effektiviteten hos en värmemotor. Värmemotoreffektivitetär förhållandet mellan mekaniskt arbete och mängden värme som tas emot från värmaren: Med hänsyn till relation (1) har vi också (2)
Effektiviteten hos en värmemotor, som vi ser, är alltid mindre än enhet. Till exempel är effektiviteten för ångturbiner ungefär , och effektiviteten för förbränningsmotorer är ungefär . Vardagserfarenheter och fysiska experiment säger oss att i värmeväxlingsprocessen överförs värme från en mer uppvärmd kropp till en mindre upphettad, men inte tvärtom. Processer där, på grund av värmeväxling, energi spontant går från en kall kropp till en varm, som ett resultat av vilken den kalla kroppen skulle svalna ännu mer, och den heta kroppen skulle värmas upp ännu mer. Ris. 3. Kylskåp Nyckelordet här är "spontant". Om du använder en extern energikälla är det fullt möjligt att utföra processen att överföra värme från en kall kropp till en varm. Detta är vad kylskåp gör Jämfört med en värmemotor går processerna i en kylmaskin i motsatt riktning (Fig. 3). Arbetsvätska kylmaskin kallas också kylmedel. För enkelhetens skull kommer vi att betrakta det som en gas som absorberar värme under expansion och frigörs under kompression (i riktiga kylaggregat är köldmediet en flyktig lösning med låg kokpunkt, som absorberar värme under avdunstning och frigörs under kondensation). Kylskåp i en kylmaskin är det kroppen som värmen tas bort från. Kylskåpet överför en mängd värme till arbetsvätskan (gasen), vilket gör att gasen expanderar. Under kompression överför gasen värme till en varmare kropp - värmare. För att sådan värmeöverföring ska ske måste gasen komprimeras vid högre temperaturer än vid expansion. Detta är endast möjligt på grund av det arbete som utförs av en extern källa (till exempel en elmotor (i riktiga kylaggregat skapar elmotorn lågt tryck i förångaren, som ett resultat av vilket köldmediet kokar och tar bort värme; på tvärtom, i kondensorn skapar elmotorn högt tryck, under vilket köldmediet kondenserar och släpper ut varmt)). Därför visar sig mängden värme som överförs till värmaren vara större än mängden värme som tas från kylskåpet med exakt mängden: På -diagrammet går alltså kylmaskinens arbetscykel moturs. Cykelområdet är det arbete som utförs av en extern källa (fig. 4). Ris. 4. Kylskåpscykel Huvudsyftet med en kylmaskin är att kyla en viss reservoar (till exempel en frys). I det här fallet spelar denna behållare rollen som ett kylskåp, och miljön fungerar som en värmare - värmen som tas bort från behållaren försvinner in i den. En indikator på effektiviteten hos en kylmaskin är prestandakoefficient, lika med förhållandet mellan värme som avlägsnas från kylskåpet och arbetet hos en extern källa: Kylkoefficienten kan vara större än en. I riktiga kylskåp tar det värden från cirka 1 till 3. Det finns en annan intressant tillämpning: en kylmaskin kan fungera som värmepump. Då är dess syfte att värma en viss reservoar (till exempel värma ett rum) på grund av värmen som tas bort från miljön. I det här fallet kommer denna tank att vara värmaren, och miljön kommer att vara kylskåpet. En indikator på effektiviteten hos en värmepump är värmekoefficient, lika med förhållandet mellan mängden värme som överförs till den uppvärmda behållaren och den externa källans arbete: Värmekoefficientvärdena för riktiga värmepumpar ligger vanligtvis i intervallet från 3 till 5. Viktiga egenskaper hos en värmemotor är de högsta och lägsta temperaturerna på arbetsvätskan under cykeln. Dessa värden kallas därefter värmarens temperatur Och kylskåpstemperatur. Vi har sett att effektiviteten hos en värmemotor är strikt mindre än enhet. En naturlig fråga uppstår: vad är högsta möjliga verkningsgrad för en värmemotor med fasta värden på värmarens temperatur och kylskåpstemperaturen? Låt till exempel den maximala temperaturen på motorns arbetsvätska vara , och den lägsta - . Vilken är den teoretiska gränsen för effektiviteten hos en sådan motor? Svaret på denna fråga gavs av den franske fysikern och ingenjören Sadi Carnot 1824. Han uppfann och forskade om en märklig värmemotor med en idealisk gas som arbetsvätska. Denna maskin fungerar enligt Carnot cykel, bestående av två isotermer och två adiabater. Låt oss överväga direkt cykel Carnot-maskin, går medurs (Fig. 5). I detta fall fungerar maskinen som en värmemotor. Ris. 5. Carnot-cykel Isoterm. Vid denna tidpunkt bringas gasen i termisk kontakt med en temperaturvärmare och expanderar isotermiskt. En mängd värme kommer från värmaren och omvandlas helt och hållet till arbete i detta område: . Adiabata. För efterföljande kompression måste gasen överföras till en zon med lägre temperaturer. För att göra detta värmeisoleras gasen och expanderar sedan adiabatiskt i området. Vid expansion utför gasen positivt arbete, och på grund av detta minskar dess inre energi: . Isoterm. Värmeisoleringen tas bort, gasen bringas i termisk kontakt med ett temperaturkylskåp. Isotermisk kompression uppstår. Gasen överför värme till kylskåpet och gör negativt arbete. Adiabata. Detta avsnitt är nödvändigt för att återställa gasen till sitt ursprungliga tillstånd. Under adiabatisk kompression utför gasen negativt arbete, och förändringen i inre energi är positiv: . Gasen värms upp till sin ursprungliga temperatur. Carnot fann effektiviteten i denna cykel (beräkningar går tyvärr utöver skolans läroplan): (3)
Dessutom bevisade han det Carnot-cykeleffektiviteten är den maximala möjliga för alla värmemotorer med värmartemperatur och svalare temperatur . Så i exemplet ovan har vi: Vad är poängen med att använda isotermer och adiabater, och inte några andra processer? Det visar sig att isotermiska och adiabatiska processer gör en Carnot-maskin reversibel. Den kan lanseras av omvänd cykel(moturs) mellan samma värmare och kylskåp, utan att involvera andra enheter. I detta fall kommer Carnot-maskinen att fungera som en kylmaskin. Möjligheten att köra en Carnot-maskin i båda riktningarna spelar en mycket viktig roll inom termodynamiken. Detta faktum fungerar till exempel som en länk i beviset på Carnot-cykelns maximala effektivitet. Vi återkommer till detta i nästa artikel om termodynamikens andra lag. Värmemotorer orsakar allvarliga skador på miljön. Deras utbredda användning leder till ett antal negativa effekter. Förlusten av en enorm mängd termisk energi i atmosfären leder till en ökning av temperaturen på planeten. Klimatuppvärmningen hotar att resultera i smältande glaciärer och katastrofala katastrofer. Det här är problem i hela civilisationens skala. För att bekämpa de skadliga effekterna av värmemotorer är det nödvändigt att öka deras effektivitet, minska giftiga utsläpp, utveckla nya typer av bränsle och använda energi sparsamt. Carnot cykel- en reversibel cirkulär process där värme omvandlas till arbete (eller arbete till värme). Den består av sekventiellt alternerande två isotermiska och biadiabatiska processer, där arbetsvätskan är en idealisk gas. Först övervägd av N. L. S. Carnot (1824) i samband med bestämningen av termiska maskiners verkningsgrad. Carnot-cykeln är den mest effektiva cykeln av alla, den har maximal effektivitet. Carnot-cykeleffektivitet: Detta visar att effektiviteten hos Carnot-cykeln med en idealisk gas endast beror på temperaturen på värmaren (Tn) och kylskåpet (Tx). Följande slutsatser följer av ekvationen: 1. För att öka effektiviteten hos en värmemotor måste du öka temperaturen på värmaren och minska temperaturen på kylskåpet; 2. Verkningsgraden för en värmemotor är alltid mindre än 1. Carnot cykel reversibel, eftersom alla dess komponenter är jämviktsprocesser. Fråga 20: Den enklaste och kvalitativt korrekt återspeglar beteendet hos en riktig gas är van der Waals ekvation Van der Waals gastillståndsekvation- en ekvation som förbinder de huvudsakliga termodynamiska storheterna i van der Waals gasmodell. Även om den ideala gasmodellen väl beskriver beteendet hos verkliga gaser vid låga tryck och höga temperaturer, är dess överensstämmelse med experiment mycket sämre under andra förhållanden. I synnerhet manifesteras detta i det faktum att riktiga gaser kan omvandlas till ett flytande och till och med ett fast tillstånd, men idealiska gaser kan inte. Den termiska tillståndsekvationen (eller ofta helt enkelt tillståndsekvationen) är förhållandet mellan tryck, volym och temperatur. För en mullvad van der Waals gas den har formen. Arbetsvätskan, som tar emot en viss mängd värme Q 1 från värmaren, ger en del av denna mängd värme, lika med modul |Q2|, till kylskåpet. Därför kan det nedlagda arbetet inte bli större A = Q 1- |Q 2 |. Förhållandet mellan detta arbete och mängden värme som tas emot av den expanderande gasen från värmaren kallas effektivitet
värmemotor: Verkningsgraden för en värmemotor som arbetar i en sluten cykel är alltid mindre än en. Uppgiften för termisk kraftteknik är att göra verkningsgraden så hög som möjligt, det vill säga att använda så mycket av värmen som tas emot från värmaren som möjligt för att producera arbete. Hur kan detta uppnås? Carnot cykel. Låt oss anta att gasen är i en cylinder, vars väggar och kolv är gjorda av ett värmeisolerande material och botten är gjord av ett material med hög värmeledningsförmåga. Volymen som upptas av gasen är lika med V 1. Figur 2 Låt oss föra cylindern i kontakt med värmaren (Figur 2) och ge gasen möjlighet att expandera isotermiskt och utföra arbete .
Gasen får en viss mängd värme från värmaren Q 1. Denna process representeras grafiskt av en isoterm (kurva AB). Figur 3 När volymen gas blir lika med ett visst värde V 1'< V 2 ,
botten av cylindern är isolerad från värmaren ,
Efter detta expanderar gasen adiabatiskt till volymen V 2, motsvarande maximalt möjliga slag för kolven i cylindern (adiabatisk Sol). I detta fall kyls gasen till en temperatur T 2< T 1 .
På sajten alltså ABC gas fungerar (A > 0), och på sajten CDA arbete utfört på gasen (A< 0).
På platserna Sol Och AD arbete utförs endast genom att ändra gasens inre energi. Sedan förändringen i inre energi UBC = – UDA, då är arbetet under adiabatiska processer lika: ABC = –ADA. Följaktligen bestäms det totala arbetet per cykel av skillnaden i arbete som utförs under isotermiska processer (sektioner AB Och CD). Numeriskt är detta arbete lika med arean av figuren som begränsas av cykelkurvan ABCD. I riktiga motorer är det inte möjligt att implementera en cykel som består av idealiska isotermiska och adiabatiska processer. Därför är effektiviteten för cykeln som utförs i riktiga motorer alltid mindre än effektiviteten för Carnot-cykeln (vid samma temperaturer för värmare och kylskåp): Formeln visar att ju högre värmarens temperatur och ju lägre kyltemperaturen är, desto högre blir motorns verkningsgrad. Clausius ojämlikhet Mängden tillförd värme kvasi-statiskt som tas emot av systemet beror inte på övergångsvägen (bestäms endast av systemets initiala och slutliga tillstånd) - för kvasistatisk
processer Clausius-ojämlikheten förvandlas till jämställdhet
. Entropi, tillståndsfunktion S termodynamiskt system, vars förändring dS för en oändlig reversibel förändring i systemets tillstånd är lika med förhållandet mellan mängden värme som tas emot av systemet i denna process (eller tas bort från systemet) och den absoluta temperaturen T:
Storlek dSär en total differential, dvs. dess integration längs valfri godtyckligt vald väg ger skillnaden mellan värdena entropi i initial (A) och sista (B) står: Värme är inte en funktion av tillstånd, så integralen av δQ beror på den valda övergångsvägen mellan tillstånd A och B. Entropi mätt i J/(mol deg). Begrepp entropi som en funktion av systemets tillstånd postuleras termodynamikens andra lag, som uttrycks genom entropi skillnad mellan irreversibla och reversibla processer. För den första dS>δQ/T för den andra dS=δQ/T. Entropi som funktion inre energi U system, volym V och antal mol n i i komponenten är en karakteristisk funktion (se. Termodynamiska potentialer). Detta är en konsekvens av termodynamikens första och andra lag och skrivs av ekvationen: Där r - tryck, μ i - kemisk potential i komponenten. Derivat entropi av naturliga variabler U, V Och n iär lika: Enkla formler ansluter entropi med värmekapacitet vid konstant tryck S sid och konstant volym Cv: Genom att använda entropi villkor är formulerade för att uppnå termodynamisk jämvikt i ett system vid konstant intern energi, volym och antal mol i komponenten (isolerat system) och stabilitetsvillkoret för sådan jämvikt: Detta betyder det entropi av ett isolerat system når ett maximum i ett tillstånd av termodynamisk jämvikt. Spontana processer i systemet kan bara ske i riktning mot att öka entropi. Entropi tillhör en grupp termodynamiska funktioner som kallas Massier-Planck-funktioner. Andra funktioner som tillhör denna grupp är Massier-funktionen F 1 = S - (1/T)U och Planck-funktionen Ф 2 = S - (1/T)U - (p/T)V, kan erhållas genom att tillämpa Legendre-transformen på entropin. Enligt termodynamikens tredje lag (se. Termisk teorem), ändra entropi i en reversibel kemisk reaktion mellan ämnen i kondenserat tillstånd tenderar till noll vid T→0: Plancks postulat (en alternativ formulering av termiska satsen) säger att entropi alla kemiska föreningar i ett kondenserat tillstånd vid absolut nolltemperatur är villkorligt noll och kan tas som utgångspunkt vid bestämning av det absoluta värdet entropiämnen vid vilken temperatur som helst. Ekvationerna (1) och (2) definierar entropi upp till en konstant period. I kemikalier termodynamik Följande begrepp används ofta: standard entropi S0, dvs. entropi vid tryck r=1,01·105 Pa (1 atm); standard entropi kemisk reaktion dvs. standardskillnad entropier produkter och reagenser; partiell molar entropi komponent i ett flerkomponentsystem. För att beräkna kemiska jämvikter, använd formeln: Där TILL - jämviktskonstant, och - respektive standard Gibbs energi, entalpi och reaktionens entropi; R- gaskonstant. Definition av begreppet entropi för ett icke-jämviktssystem är baserat på idén om lokal termodynamisk jämvikt. Lokal jämvikt innebär uppfyllandet av ekvation (3) för små volymer av ett system som inte är i jämvikt som helhet (se. Termodynamik av irreversibla processer). Under irreversibla processer i systemet kan produktion (förekomst) uppstå entropi. Full differential entropi bestäms i detta fall av Carnot-Clausius-ojämlikheten: Där dS i > 0 - differential entropi, inte relaterat till värmeflöde utan på grund av produktion entropi på grund av irreversibla processer i systemet ( diffusion. värmeledningsförmåga kemiska reaktioner, etc.). Lokal produktion entropi (t- tid) representeras som summan av produkter av generaliserade termodynamiska krafter X i till generaliserade termodynamiska flöden J i: Produktion entropi på grund av till exempel diffusion av en komponent i på grund av materiens kraft och flöde J; produktion entropi på grund av en kemisk reaktion - med våld X=A/T, Var A-kemisk affinitet och flöde J, lika med reaktionshastigheten. I statistisk termodynamik entropi isolerat system bestäms av relationen: var k - Boltzmann konstant. - termodynamisk vikt av tillståndet, lika med antalet möjliga kvanttillstånd i systemet med givna värden för energi, volym, antal partiklar. Systemets jämviktstillstånd motsvarar jämlikheten mellan populationer av enstaka (icke-degenererade) kvanttillstånd. Ökande entropi i irreversibla processer är associerad med etableringen av en mer sannolik fördelning av den givna energin i systemet mellan enskilda delsystem. Generaliserad statistisk definition entropi, som även gäller för icke-isolerade system, ansluter entropi med sannolikheterna för olika mikrotillstånd enligt följande: Där w i- sannolikhet i-e staten. Absolut entropi en kemisk förening bestäms experimentellt, huvudsakligen med den kalorimetriska metoden, baserat på förhållandet: Användningen av den andra principen tillåter oss att bestämma entropi kemiska reaktioner baserade på experimentella data (elektromotorisk kraftmetod, ångtrycksmetod, etc.). Beräkning möjlig entropi kemiska föreningar med statistiska termodynamiska metoder, baserade på molekylkonstanter, molekylvikt, molekylär geometri och normala vibrationsfrekvenser. Detta tillvägagångssätt genomförs framgångsrikt för ideala gaser. För kondenserade faser ger statistiska beräkningar betydligt mindre noggrannhet och utförs i ett begränsat antal fall; Under de senaste åren har betydande framsteg gjorts på detta område. Relaterad information. två, adiabat (Fig. 5.16). Kurvorna 1-2 och 3-4 är isotermer och 2-3 och 4-1 är adiabater. Värmemängd Q2 (5.12.6) Sedan, enligt formel (5.12.7), kommer arbetet att utföras på det Detta är huvudresultatet: (5.12.13)Värmemotordrift

Carnot motor

Sorter
Andra typer av värmemotorer

Hur kan du öka effektiviteten

Ämnen för kodifieraren för Unified State Examination: principer för drift av värmemotorer, effektivitet hos en värmemotor, värmemotorer och miljöskydd.
Värmemotorer finns i två typer, beroende på riktningen för de processer som sker i dem.Värmemotorer


Kylmaskiner

bilar.
Carnot värmemotor

Värmemotorer och miljöskydd
Klimatuppvärmningen orsakas också av ansamling av koldioxid i atmosfären, vilket bromsar utsläppet av jordens värmestrålning ut i rymden (växthuseffekten).
På grund av den höga koncentrationen av bränsleförbränningsprodukter försämras miljösituationen.
![]()
![]()
För första gången föreslog den franske fysikern och ingenjören S. Carnot 1824 den mest perfekta cykliska processen, bestående av isotermer och adiabater.

Den kylda gasen kan nu komprimeras isotermiskt vid en temperatur T2. För att göra detta måste den bringas i kontakt med en kropp som har samma temperatur T 2, dvs med ett kylskåp ,
och komprimera gasen med en yttre kraft. Men i denna process kommer gasen inte att återgå till sitt ursprungliga tillstånd - dess temperatur kommer alltid att vara lägre än T 1.
Därför bringas isotermisk kompression till en viss mellanvolym V 2 '> V 1(isoterm CD). I det här fallet avger gasen lite värme till kylskåpet Q2, lika med kompressionsarbetet som utförs på den. Därefter komprimeras gasen adiabatiskt till en volym V 1, samtidigt stiger dess temperatur till T 1(adiabatisk D.A.). Nu har gasen återgått till sitt ursprungliga tillstånd, där dess volym är lika med V 1, temperatur - T1, tryck - p 1, och cykeln kan upprepas igen.
Endast en del av mängden värme omvandlas faktiskt till nyttigt arbete QT, mottagen från värmaren, lika med QT 1 – |QT 2 |. Så, i Carnot-cykeln, användbart arbete A = QT 1– |QT 2 |.
Den maximala effektiviteten för en ideal cykel, som visas av S. Carnot, kan uttryckas i termer av värmarens temperatur (T 1) och kylskåp (T 2):![]()
![]()
Carnot Nicolas Leonard Sadi (1796-1832) - en begåvad fransk ingenjör och fysiker, en av grundarna av termodynamiken. I sitt arbete "Reflections on the driving force of fire and on machines capable of develop this force" (1824) visade han först att värmemotorer endast kan utföra arbete i processen att överföra värme från en varm kropp till en kall. Carnot kom med en idealisk värmemotor, beräknade effektiviteten för den ideala maskinen och bevisade att denna koefficient är den maximala möjliga för någon riktig värmemotor. 
Som ett stöd för sin forskning uppfann Carnot (på papper) 1824 en idealisk värmemotor med en idealisk gas som arbetsvätska. Carnot-motorns viktiga roll ligger inte bara i dess möjliga praktiska tillämpning, utan också i det faktum att den tillåter oss att förklara principerna för drift av värmemotorer i allmänhet; Det är lika viktigt att Carnot, med hjälp av sin motor, lyckades ge ett betydande bidrag till underbyggandet och förståelsen av termodynamikens andra lag. Alla processer i en Carnot-maskin betraktas som jämvikt (reversibla). En reversibel process är en process som fortskrider så långsamt att den kan betraktas som en sekventiell övergång från ett jämviktstillstånd till ett annat etc., och hela denna process kan utföras i motsatt riktning utan att ändra det utförda arbetet och mängden av värme överförs. (Observera att alla verkliga processer är irreversibla) En cirkulär process eller cykel utförs i maskinen, där systemet, efter en serie transformationer, återgår till sitt ursprungliga tillstånd. Carnot-cykeln består av två isotermer och två adiabater. Kurvorna A - B och C - D är isotermer, och B - C och D - A är adiabater. Först expanderar gasen isotermiskt vid temperatur Ti. Samtidigt tar den emot mängden värme Q 1 från värmaren. Sedan expanderar den adiabatiskt och byter inte värme med de omgivande kropparna. Detta följs av isotermisk komprimering av gasen vid temperatur T2. I denna process överför gasen mängden värme Q 2 till kylskåpet. Slutligen komprimeras gasen adiabatiskt och återgår till sitt ursprungliga tillstånd. Under isotermisk expansion fungerar gasen A" 1 >0, lika med mängden värme Q 1. Med adiabatisk expansion B - C är positivt arbete A" 3 lika med minskningen av intern energi när gasen kyls från temperatur T 1 till temperatur T 2: A" 3 =- dU 1,2 =U(T 1)-U(T 2). Isotermisk kompression vid temperatur T 2 kräver arbete A 2 som utförs på gasen. Gasen utför motsvarande negativt arbete A" 2 = -A2 = Q 2. Slutligen kräver adiabatisk kompression arbete på gasen A 4 = dU 2,1. Själva gasens arbete A" 4 = -A 4 = -dU 2.1 = U(T 2) -U(T 1). Därför är det totala arbetet för gasen under två adiabatiska processer noll. Under cykeln, gas fungerar A" = A" 1 + A" 2 =Q 1 + Q 2 =|Q 1 |-|Q 2 |. Detta arbete är numeriskt lika med arean av figuren som begränsas av cykelkurvan För att beräkna effektiviteten är det nödvändigt att beräkna arbetet för isotermiska processer A - B och C - D. Beräkningar leder till följande resultat:
 (2) Verkningsgraden för en Carnot värmemotor är lika med förhållandet mellan skillnaden mellan värmarens och kylskåpets absoluta temperatur och värmarens absoluta temperatur. Den huvudsakliga betydelsen av Carnots formel (2) för effektiviteten hos en ideal maskin är att den bestämmer den maximala möjliga verkningsgraden för en värmemotor. Carnot bevisade följande teorem: någon riktig värmemotor som arbetar med en värmare vid temperatur T 1 och ett kylskåp vid temperatur T 2 kan inte ha en verkningsgrad som överstiger verkningsgraden för en idealisk värmemotor.
(2) Verkningsgraden för en Carnot värmemotor är lika med förhållandet mellan skillnaden mellan värmarens och kylskåpets absoluta temperatur och värmarens absoluta temperatur. Den huvudsakliga betydelsen av Carnots formel (2) för effektiviteten hos en ideal maskin är att den bestämmer den maximala möjliga verkningsgraden för en värmemotor. Carnot bevisade följande teorem: någon riktig värmemotor som arbetar med en värmare vid temperatur T 1 och ett kylskåp vid temperatur T 2 kan inte ha en verkningsgrad som överstiger verkningsgraden för en idealisk värmemotor. 
I Otto-cykeln sugs arbetsblandningen först in i cylindern 1-2, sedan adiabatisk kompression 2-3 och efter dess isokoriska förbränning 3-4, åtföljd av en ökning av temperaturen och trycket hos förbränningsprodukterna, deras adiabatiska expansion 4-5 inträffar, då ett isokoriskt tryckfall 5 -2 och isobarisk utdrivning av avgaser av kolven 2-1. Eftersom inget arbete utförs på isokorer, och arbetet under sugning av arbetsblandningen och utdrivning av avgaser är lika och motsatt i tecken, är det användbara arbetet för en cykel lika med skillnaden i arbete på adiabaterna av expansion och kompression och är grafiskt avbildad av cykelns område.
Om man jämför verkningsgraden hos en riktig värmemotor med effektiviteten hos Carnot-cykeln, bör det noteras att i uttryck (2) kan temperaturen T2 i undantagsfall sammanfalla med den omgivande temperaturen, som vi tar för ett kylskåp, men i I allmänhet överstiger den omgivningstemperaturen. Så, till exempel, i förbränningsmotorer, bör T2 förstås som temperaturen på avgaserna, och inte temperaturen i den miljö i vilken avgaserna produceras.

Figuren visar cykeln för en fyrtakts förbränningsmotor med isobar förbränning (dieselcykel). Till skillnad från föregående cykel absorberas den i avsnitt 1-2. atmosfärisk luft, som utsätts för adiabatisk kompression i avsnitt 2-3 till 3 10 6 -3 10 5 Pa. Det insprutade flytande bränslet antänds i en miljö med högt komprimerad, och därför uppvärmd, luft och brinner isobariskt 3-4, och sedan sker en adiabatisk expansion av förbränningsprodukterna 4-5. De återstående processerna 5-2 och 2-1 fortsätter på samma sätt som i föregående cykel. Man bör komma ihåg att i förbränningsmotorer är cyklerna villkorligt stängda, eftersom cylindern före varje cykel är fylld med en viss massa av arbetsämne, som kastas ut från cylindern i slutet av cykeln.
Men temperaturen i kylskåpet kan praktiskt taget inte vara mycket lägre än omgivningstemperaturen. Du kan höja värmarens temperatur. Men vilket material som helst (fast kropp) har begränsad värmebeständighet eller värmebeständighet. När den värms upp förlorar den gradvis sina elastiska egenskaper och vid en tillräckligt hög temperatur smälter den. Nu är ingenjörernas huvudinsatser inriktade på att öka motorernas effektivitet genom att minska friktionen hos deras delar, bränsleförluster på grund av ofullständig förbränning, etc. Verkliga möjligheter att öka effektiviteten här är fortfarande stora. Så för en ångturbin är ångans initiala och slutliga temperaturer ungefär följande: T 1 = 800 K och T 2 = 300 K. Vid dessa temperaturer är det maximala värdet av verkningsgradskoefficienten:
![]() Det faktiska verkningsgradsvärdet på grund av olika typer av energiförluster är cirka 40 %. Den maximala verkningsgraden - cirka 44% - uppnås av förbränningsmotorer. Verkningsgraden för någon värmemotor kan inte överstiga det maximala möjliga värdet
Det faktiska verkningsgradsvärdet på grund av olika typer av energiförluster är cirka 40 %. Den maximala verkningsgraden - cirka 44% - uppnås av förbränningsmotorer. Verkningsgraden för någon värmemotor kan inte överstiga det maximala möjliga värdet ![]() där T 1 är den absoluta temperaturen för värmaren och T 2 är den absoluta temperaturen för kylskåpet. Att öka effektiviteten hos värmemotorer och föra den närmare det maximala möjliga är den viktigaste tekniska uppgiften.
där T 1 är den absoluta temperaturen för värmaren och T 2 är den absoluta temperaturen för kylskåpet. Att öka effektiviteten hos värmemotorer och föra den närmare det maximala möjliga är den viktigaste tekniska uppgiften.



![]()
![]()
![]()

På grund av det faktum att en del av värmen under driften av värmemotorer oundvikligen överförs till kylskåpet, kan motorernas effektivitet inte vara lika med enhet. Det är av stort intresse att hitta den maximala möjliga verkningsgraden för en värmemotor som arbetar med en värmare vid temperatur Tg och ett kylskåp vid temperatur T2. Detta gjordes först av den franske ingenjören och vetenskapsmannen Sadi Carnot.
Idealisk Carnot värmemotor
Carnot kom med en idealisk värmemotor med en idealisk gas som arbetsvätska. Alla processer i en Carnot-maskin betraktas som jämvikt (reversibla).
En cirkulär process eller cykel utförs i maskinen, där systemet, efter en serie transformationer, återgår till sitt ursprungliga tillstånd. Carnot-cykeln består av två isotermer och
Först expanderar gasen isotermiskt vid temperatur T1. Samtidigt får den en mängd värme från värmaren. Sedan expanderar den adiabatiskt och byter inte värme med de omgivande kropparna. Vad som följer
isotermisk gaskompression vid o~ ^
temperatur T2. Gas ger ut i detta ris g jg
process i kylen, mängden värme Q2 Slutligen komprimeras gasen adiabatiskt och återgår till sitt ursprungliga tillstånd.
Under isotermisk expansion utför gasen arbete > 0, lika med mängden värme. Vid adiabatisk expansion 2-3 är det positiva arbetet A"3 lika med minskningen av inre energi när gasen kyls från temperatur 7\ till temperatur. T2: A"3 = -AU12 = ШТХ) - U (T2).
Isotermisk kompression vid temperatur T2 kräver arbete A2 som utförs på gasen. Gasen utför motsvarande negativt arbete A 2
Q2. Slutligen kräver adiabatisk kompression arbete på gasen A4 = AU21. Själva arbetet
Carnot Nicolas Leonard Sadi (1796-1832) - en begåvad fransk ingenjör och fysiker, en av grundarna av termodynamiken. I sitt arbete "Reflections on the driving force of fire and on machines capable of develop this force" (1824) visade han först att värmemotorer endast kan utföra arbete i processen att överföra värme från en varm kropp till en kall. Carnot kom med en idealisk värmemotor, beräknade effektiviteten för den ideala maskinen och bevisade att denna koefficient är den maximala möjliga för någon riktig värmemotor. gas А\ = -Л4 = -At/2i = - ШТх). Därför är den totala ra
flödet av gas under två adiabatiska processer är lika med noll.
Under en cykel fungerar gasen
A"= A[ + A"2=Q1 + Q2 = IQJ - |Q2|. (5.12.1)
Detta arbete är numeriskt lika med den yta av figuren som begränsas av cykelkurvan (skuggad i fig. 5.16).
För att beräkna effektiviteten måste du beräkna arbetet för isotermiska processer 1-2 och 3-4. Beräkningar leder till följande resultat:
(5.12.2) Verkningsgraden för en Carnot-värmemotor är lika med förhållandet mellan skillnaden mellan värmarens och kylskåpets absoluta temperatur och värmarens absoluta temperatur.
Vi kan uttrycka det arbete som maskinen utför per cykel och mängden värme Q2 som överförs till kylskåpet genom maskinens effektivitet och mängden värme som tas emot från värmaren enligt definitionen av effektivitet
L" = l Värmemängd
Q2 = A" - = TlQi - Qi = QiOl - D- (5.12.4)
Sedan t) |Q2| = (1-71)QI. (5.12.5)
Den idealiska kylmaskinen
Carnot-cykeln är reversibel, så den kan göras i motsatt riktning. Det kommer inte längre att vara en värmemotor, utan en idealisk kylmaskin.
Processerna kommer att gå i omvänd ordning. Arbete A utförs för att köra maskinen. Mängden värme Qx överförs av arbetsvätskan till en värmare vid en högre temperatur, och mängden värme Q2 tillförs arbetsvätskan från kylskåpet (Fig. 5.17). Värme överförs från en kall kropp till en varm, varför maskinen kallas för en kylmaskin.?
Värmemängd Q
"G
ArbeteA
KYLSKÅPStemperatur T2
Ris. 5.17
Men detta motsäger inte termodynamikens andra lag: värme överförs inte av sig själv, utan genom att utföra arbete.
Låt oss uttrycka värmemängderna Q1 och Q2 genom arbetet A och effektiviteten hos maskinen T|. Eftersom enligt formel (5.12.3) A" = riQj = -A, alltså
Mängden värme som överförs av arbetsvätskan är som alltid negativ. Uppenbarligen |Qj| = ^. Enligt uttrycket
(5.12.4) mängd värme Q2 = QiCn ~ 1) eller med hänsyn till relation (5.12.3) (5.12.7)
q2= V1a>0- Denna mängd värme tas emot av arbetsvätskan från kylskåpet.
Kylskåpet fungerar som en värmepump. Mängden värme Qj som överförs till den varma kroppen är större än den mängd som tas från kylskåpet. Enligt formel (5.12.7) Q2 = ^ -A = -Qj - A. Därav
| Q1\=A + Q2. (5.12.8)
Effektiviteten hos en kylmaskin bestäms av
є = -г, eftersom dess syfte kan tas bort så mycket som möjligt
större mängd värme från det kylda systemet samtidigt som du gör så lite arbete som möjligt. Värdet є kallas prestandakoefficienten. För en idealisk kylmaskin enligt formlerna (5.12.7) och (5.12.2)
Qn T2
det vill säga ju lägre temperaturskillnaden är, desto högre kylkoefficient, och ju lägre, desto lägre är temperaturen på den kropp från vilken värme avlägsnas. Uppenbarligen kan prestandakoefficienten vara större än en. För riktiga kylskåp är det fler än tre. En typ av kylmaskin är en luftkonditionering, som tar värme från ett rum och överför den till den omgivande luften.
Värmepump
Vid uppvärmning av rum med elvärmare är det energimässigt mer lönsamt att använda en värmepump, snarare än en batterivärme som värms upp med ström. Pumpen kommer dessutom att överföra mängden värme Q2 från den omgivande luften till rummet. Detta görs dock inte på grund av den höga kostnaden för kylaggregatet jämfört med en konventionell elektrisk spis eller öppen spis.
Vid användning av en värmepump är mängden värme Qj som tas emot av den uppvärmda kroppen, och inte mängden värme Q2 som ges till den kalla kroppen, av praktiskt intresse. Därför är kännetecknet för en värmepump:
lQi|
kallas värmekoefficient?från= .
För en idealisk maskin, med hänsyn till relationerna (5.12.6) och (5.12.2), kommer vi att ha Єot=m^V" (5.12.10)
1 1 ~ 1 2
där 7"1 är den absoluta temperaturen i det uppvärmda rummet, och G2 är den absoluta temperaturen för den atmosfäriska luften. Uppvärmningskoefficienten är alltså alltid större än enhet. För verkliga enheter vid omgivningstemperatur t2 = 0 °C och rumstemperatur t-l = 25 °C єot = 12 Mängden värme som överförs till rummet är nästan 12 gånger större än mängden elektricitet som förbrukas.
Maximal verkningsgrad för värmemotorer
(Carnots sats)
Den huvudsakliga betydelsen av formeln (5.12.2) erhållen av Carnot för effektiviteten hos en ideal maskin är att den bestämmer den maximala möjliga verkningsgraden för en värmemotor.
Carnot bevisade, baserat på termodynamikens andra lag, följande teorem: någon verklig värmemotor som arbetar med en värmare vid temperaturen Tt och ett kylskåp vid temperaturen T2 kan inte ha en verkningsgrad som överstiger verkningsgraden för en ideal värmemotor.
Låt oss först betrakta en värmemotor som arbetar i en reversibel cykel med en riktig gas. Cykeln kan vara vad som helst, det är bara viktigt att temperaturen på värmaren och kylskåpet är T1-T2.
Låt oss anta att effektiviteten hos en annan värmemotor (som inte körs på en Carnot-cykel) g\" > Г|. Maskinerna arbetar med en gemensam värmare och ett gemensamt kylskåp. Låt Carnot-maskinen arbeta på en omvänd cykel (som en kylning). maskin), och den andra maskinen på en framåtcykel (Fig. 5.18) Värmemotorn utför arbete lika med, enligt formlerna (5.12.3) och (5.12.5)
A" = r\"Q[ = ^_,\Q"2\. (5.12.11)
En kylmaskin kan alltid utformas så att den tar värmemängden Q2 = \Q2\ från kylen.
A = (5.12.12)
Eftersom av villkor G|" > m|, sedan A" > A. Därför kan en värmemotor driva en kylmaskin, och det kommer fortfarande att finnas ett överskott av arbete kvar. Detta överskottsarbete görs av värme som tas från en källa. Värme överförs trots allt inte till kylskåpet när två maskiner går samtidigt. Men detta motsäger termodynamikens andra lag.
Om vi antar att T| > T|", då kan du tvinga en annan maskin att arbeta i en omvänd cykel, och en Carnot-maskin - i en framåtcykel. Vi kommer återigen till en motsägelse med termodynamikens andra lag. Följaktligen har två maskiner som arbetar i reversibla cykler samma effektivitet: r|" = Г|.
Det är en annan sak om den andra maskinen arbetar på en irreversibel cykel. Om vi antar G)" > G), så kommer vi återigen till en motsägelse med termodynamikens andra lag. Emellertid antagande G)"
Verkningsgrad för riktiga värmemotorer
Formel (5.12.13) ger den teoretiska gränsen för maximal verkningsgrad för värmemotorer. Den visar att ju högre temperatur på värmaren och ju lägre temperatur på kylskåpet, desto effektivare är en värmemotor. Endast vid en kylskåpstemperatur lika med absolut noll, Г| = 1.
Men temperaturen i kylskåpet kan praktiskt taget inte vara mycket lägre än omgivningstemperaturen. Du kan höja värmarens temperatur. Men vilket material som helst (fast kropp) har begränsad värmebeständighet eller värmebeständighet. När den värms upp förlorar den gradvis sina elastiska egenskaper och vid en tillräckligt hög temperatur smälter den.
Nu är ingenjörernas huvudinsatser inriktade på att öka motorernas effektivitet genom att minska friktionen hos deras delar, bränsleförluster på grund av ofullständig förbränning, etc. Verkliga möjligheter att öka effektiviteten här är fortfarande stora. För en ångturbin är ångans initiala och slutliga temperaturer ungefär som följer: T1 = 800 K och T2 = 300 K. Vid dessa temperaturer är det maximala värdet av verkningsgradskoefficienten
T1 - T2
Lmax= =0,62 = 62%.
Det faktiska verkningsgradsvärdet på grund av olika typer av energiförluster är cirka 40 %. Den maximala verkningsgraden - cirka 44% - uppnås av förbränningsmotorer.
Effektiviteten av någon termisk
motorn får inte överskrida max
T1~T2
möjligt värde Lshchakh = -^-» - absolut
11
är temperaturen på värmaren och T2 är den absoluta
kylskåpstemperatur.
Att öka effektiviteten hos värmemotorer och föra den närmare det maximala möjliga är det viktigaste
tekniskt problem.
- Ny
- Ilya Frank - enkla sagor på fransk Modern litteratur på franska
- Frodiga, viktiga, som en gentleman, Delikat sammet... Du hittar dem i Holland, överallt hålls de i hög aktning
- Escape from the room Spel escape from the room nivå 7
- Gissa hjältarna i utländska sagor Gåtor om seriefigurer
- Fanns det ett tatarisk-mongoliskt ok?
- Varje nation har den regering den vill ha
- 9 änglar i ortodoxin
- Upprätthålla bokföring för flera organisationer
- Hur kan du lämna tillbaka för mycket innehållen personlig inkomstskatt?
- Populär
- Värmemotoreffektivitet
- Cyanobakterier kan "kortsluta" fotosyntesprocessen Lätt fas av fotosyntesen
- Ultravioletta strålningskällor
- Ekaterina Genieva. Evigt minne! Katerina Gordeeva: Till minne av Ekaterina Genieva. "Det är inte läskigt att dö Det är läskigt att svara på frågor Direktören för biblioteket för utländsk litteratur Genieva
- Hur man gör kyckling hemma. Kycklingnuggets. Hur man lagar rejäla nuggets som på McDonald's med egna händer steg för steg
- Förbered en läcker sås med päron
- Gelé av juice och grädde i lager Gör gelé av torr grädde
- Lektionssammanfattning läsning "Ljud och bokstaven Sh" Lektionssammanfattning om undervisning i alfabetisering bokstaven sh
- Med hjälp av artikeln THE







![Mål: utveckla förmågan att identifiera och karakterisera ljudet [w], att se och särskilja... Mål: utveckla förmågan att identifiera och karakterisera ljudet [w], att se och särskilja...](https://i0.wp.com/learnathome.ru/files/media/anap.png)