يحدث تكاثر فيروس الأنفلونزا في. كيف يعمل فيروس الأنفلونزا؟ التعرف على فيروسات الأنفلونزا باستخدام RTG
وهي طفيليات ملزمة داخل الخلايا، مما يعني أنها لا تستطيع التكاثر أو نقل جيناتها دون مساعدة. والجسيم الفيروسي الوحيد (الفيريون) هو في حد ذاته خامل. عندما يصيب الفيروس خلية، فإنه يستخدم الإنزيمات والجزء الأكبر من بنية الخلية للتكاثر.
على عكس ما نراه في عمليات انقسام الخلايا مثل و، فإن تكاثر الفيروس ينتج العديد من النسل الذي يدمر الخلية المضيفة ثم يصيب الخلايا الأخرى في الجسم.
المادة الوراثية الفيروسية
يمكن أن تحتوي الفيروسات على حمض نووي مفرد أو مزدوج الشريط أو حمض نووي ريبوزي. ويعتمد نوع المادة الوراثية الموجودة في فيروس معين على طبيعتها ووظيفتها. تختلف الطبيعة الدقيقة لما يحدث بعد إصابة المضيف باختلاف طبيعة الفيروس.
ستكون عملية النسخ مختلفة بالنسبة لفيروسات dsDNA، وssDNA، وdsRNA، وفيروسات RNA المفردة. على سبيل المثال، يجب على فيروسات الحمض النووي المزدوج الشريطة عادةً أن تدخل الخلايا المضيفة قبل أن تتمكن من التكاثر. ومع ذلك، فإن فيروسات الحمض النووي الريبوزي المفردة الجديلة تتكاثر بشكل أساسي في الخلايا المضيفة.
بمجرد أن يصيب الفيروس مضيفًا، يتم إنتاج مكونات السلالة الفيروسية بواسطة الآلات الخلوية، ويكون تجميع القفيصة الفيروسية عملية غير إنزيمية. يمكن للفيروسات عادةً أن تصيب عددًا محدودًا فقط من المضيفين. آلية "القفل والمفتاح" هي التفسير الأكثر شيوعًا لهذه الظاهرة. يجب أن تتطابق بعض البروتينات الموجودة على جسيم الفيروس مع بروتينات مستقبلية معينة على سطح الخلية لمضيف معين.
كيف تصيب الفيروسات الخلايا؟
تتم العملية الأساسية للعدوى وتكاثر الفيروس على 6 مراحل:
- الامتزاز - يرتبط الفيروس بالخلية المضيفة.
- الدخول - يقوم الفيروس بإدخال الجينوم الخاص به إلى الخلية المضيفة.
- تكرار الجينوم الفيروسي - يتم تكرار الجينوم الفيروسي باستخدام البنية الخلوية للمضيف.
- التجميع - تتشكل المكونات والإنزيمات الفيروسية وتبدأ في التجمع.
- النضج - تتطور الفيروسات من المكونات المجمعة.
- الخروج - تندلع فيروسات جديدة من الخلية المضيفة بحثًا عن ضحايا جدد لإصابتهم.
يمكن للفيروسات أن تصيب أي نوع من الخلايا، بما في ذلك
تشمل عائلة فيروسات orthomyxoviruses (اليونانية orthos - صحيح، tukha - mucus) فيروسات الأنفلونزا من الأنواع A، B، C، والتي، مثل الفيروسات المخاطانية، لها صلة بالموسين. تصيب فيروسات الأنفلونزا A البشر وبعض أنواع الحيوانات (الخيول والخنازير وغيرها) والطيور. فيروسات الأنفلونزا من النوعين B وC مسببة للأمراض للبشر فقط. تم عزل أول فيروس أنفلونزا بشري من البشر في عام 1933 بواسطة دبليو. سميث، وسي. أندروز، وبي. لادو (سلالة WS) عن طريق إصابة القوارض البيضاء. في وقت لاحق، تم تصنيف هذا الفيروس على أنه من النوع A. في عام 1940، اكتشف T. Francis وT. Megill فيروس الأنفلونزا من النوع B، وفي عام 1949، اكتشف R. Taylor فيروس الأنفلونزا من النوع C. عند تصنيف فيروسات الأنفلونزا، كانت هناك دائمًا بعض الصعوبات تمت مواجهتها، المرتبطة بتقلبها المستضدي. تنقسم فيروسات الأنفلونزا إلى ثلاثة أنواع A وB وC. ويتضمن النوع A عدة أنواع فرعية تختلف عن بعضها البعض في مستضداتها - الهيماجلوتينين والنورامينيداز. وفقا لتصنيف منظمة الصحة العالمية (1980)، تنقسم فيروسات الأنفلونزا البشرية والحيوانية من النوع A إلى 13 نوعا فرعيا مستضديا على أساس الراصة الدموية (H1-H13) و 10 على أساس النورامينيداز (N1-N10). من بين هذه الفيروسات، تشتمل فيروسات الأنفلونزا البشرية من النوع A على ثلاثة هيماجلوتينين (HI وH2 وNZ) واثنين من النورامينيداز (N1 وN2).بالنسبة للفيروس من النوع A، يُشار إلى النوع الفرعي من الراصة الدموية والنورامينيداز بين قوسين. على سبيل المثال، فيروس الأنفلونزا A: خاباروفسك/90/77 (H1N1).الهيكل والتركيب الكيميائي
فيروس الأنفلونزا له شكل كروي، يبلغ قطره 80-120 نانومتر. الأشكال الشبيهة بالخيط أقل شيوعًا. القفيصة النووية ذات التناظر الحلزوني عبارة عن حبلا من البروتين النووي الريبي (RNP) مرتبة في حلزون مزدوج يشكل قلب الفيريون. ويرتبط به بوليميريز الحمض النووي الريبي (RNA) والنوكلياز الداخلية (P1 وP3). النواة محاطة بغشاء يتكون من بروتين M، الذي يربط RNP بطبقة دهنية ثنائية من الغلاف الخارجي وعمليات إبري تتكون من الهيماجلوتينين والنورامينيداز.تحتوي الفيروسات على حوالي 1% RNA، 70% بروتين، 24% دهون و5 % كربوهيدرات. الدهون والكربوهيدرات هي جزء من البروتينات الدهنية والبروتينات السكرية الموجودة في الغلاف الخارجي وهي ذات أصل خلوي. يتم تمثيل جينوم الفيروس بواسطة جزيء الحمض النووي الريبي (RNA) المجزأ. تحتوي فيروسات الأنفلونزا من النوع A وB على 8 أجزاء من الحمض النووي الريبوزي، 5 منها تشفر بروتينًا واحدًا، وآخر 3 تشفر بروتينين لكل منها.المستضدات
تختلف فيروسات الأنفلونزا A وB وC عن بعضها البعض في المستضد الخاص بالنوع المرتبط بـ RNP (بروتين NP) وبروتين M-matrix، الذي يعمل على تثبيت بنية الفيريون، ويتم اكتشاف هذه المستضدات في RSC. يتم تحديد الخصوصية الأضيق للفيروس من النوع A بواسطة مستضدين سطحيين آخرين - الراصة الدموية H والنورامينيداز N، المعينين بأرقام تسلسلية. الهيماجلوتينين هو بروتين سكري معقد له خصائص وقائية. إنه يحفز في الجسم تكوين أجسام مضادة تحييد الفيروس - مضادات الهيماجلوتينين، المكتشفة في RTGA. يحدد تباين الراصة الدموية (مستضد H) الانجراف المستضدي وتحول فيروس الأنفلونزا. يشير الانجراف المستضدي إلى تغييرات طفيفة في المستضد H الناجم عن طفرات نقطية في الجين الذي يتحكم في تكوينه. يمكن أن تتراكم مثل هذه التغييرات في النسل تحت تأثير عوامل انتقائية مثل الأجسام المضادة. يؤدي هذا في النهاية إلى تحول كمي، يتم التعبير عنه في تغيير في الخصائص المستضدية للهيماجلوتينين. مع التحول المستضدي، يحدث استبدال كامل للجين، والذي قد يعتمد على إعادة التركيب بين فيروسين. يؤدي هذا إلى تغيير في النوع الفرعي من الراصة الدموية أو النيورامينيداز، وفي بعض الأحيان كلا المستضدين، وظهور متغيرات مستضدية جديدة بشكل أساسي للفيروس، مما يسبب أوبئة وجائحات كبرى، كما أن الهيماجلوتينين هو أيضًا مستقبل يتم من خلاله امتصاص الفيروس على الخلايا الحساسة. بما في ذلك خلايا الدم الحمراء، مما يجعلها تلتصق ببعضها البعض، وتشارك في انحلال خلايا الدم الحمراء. النورامينيداز الفيروسي هو إنزيم يحفز انقسام حمض السياليك من الركيزة. له خصائص مستضدية وفي نفس الوقت يشارك في إطلاق الفيروسات من الخلية المضيفة. يتغير النورامينيداز، مثل الهيماجلوتينين، نتيجة للانجراف المستضدي والتحول.الزراعة والتكاثر
تتم زراعة فيروسات الأنفلونزا في أجنة الدجاج وفي مزارع الخلايا. إن البيئة المثالية هي أجنة الدجاج، في التجاويف السلوية والسقاء حيث يتكاثر الفيروس خلال 36-48 ساعة. والأكثر حساسية لفيروس الأنفلونزا هي المزارع الأولية لخلايا الكلى الجنينية البشرية وبعض الحيوانات. يصاحب تكاثر الفيروس في هذه الثقافات ظهور CPE خفيف، يذكرنا بانحطاط الخلايا التلقائي. يتم امتصاص فيروسات الأنفلونزا على مستقبلات البروتين السكري في الخلايا الظهارية، والتي تخترقها من خلال الالتقام الخلوي للمستقبل. يحدث النسخ والتكرار للجينوم الفيروسي في نواة الخلية. في هذه الحالة، تتم ترجمة أجزاء الحمض النووي الريبي (RNA) الفردية المقروءة على شكل m-RNA إلى ريبوسومات، حيث يحدث تخليق البروتينات الخاصة بالفيروس. بعد تكرار الجينوم الفيروسي، يتم تشكيل مجموعة من الحمض النووي الريبي الفيروسي، والذي يستخدم في تجميع القفيصات النووية الجديدة.طريقة تطور المرض
يحدث التكاثر الأولي للفيروس في الخلايا الظهارية في الجهاز التنفسي. من خلال السطح المتآكل للغشاء المخاطي، يدخل الفيروس إلى الدم، مما يسبب تفير الدم. ويصاحب دوران الفيروس في الدم تلف الخلايا البطانية للشعيرات الدموية، مما يؤدي إلى زيادة نفاذيتها. وفي الحالات الشديدة يلاحظ نزيف في الرئتين وعضلة القلب والأعضاء الداخلية الأخرى. فيروسات الأنفلونزا، التي تدخل الغدد الليمفاوية، تلحق الضرر بالخلايا الليمفاوية، مما يؤدي إلى نقص المناعة المكتسب، مما يساهم في حدوث الالتهابات البكتيرية الثانوية، وفي حالة الأنفلونزا يحدث تسمم الجسم بدرجات متفاوتة الخطورة.حصانة
ترتبط آلية المناعة ضد الأنفلونزا بالعوامل الطبيعية للحماية غير النوعية المضادة للفيروسات، وبشكل رئيسي مع إنتاج الإنترفيرون والخلايا القاتلة الطبيعية، ويتم توفير مناعة محددة عن طريق عوامل الاستجابة الخلوية والخلطية. يتم تمثيل الأول بواسطة البلاعم والقتلة T. والثاني هو الغلوبولين المناعي، في المقام الأول مضادات الهيماجلوتينين والأجسام المضادة لمضادات اليورومينيداز، التي لها خصائص تحييد الفيروس. هذا الأخير، على عكس مضادات الهيماجلوتينين، يعمل على تحييد فيروس الأنفلونزا جزئيًا فقط، مما يمنع انتشاره. لا تتمتع الأجسام المضادة المثبتة للبروتين النووي الفيروسي بخصائص وقائية حتى بعد مرور 1.5 شهر. تختفي الأجسام المضادة من دماء الناقهين، ويتم اكتشاف الأجسام المضادة في مصل الدم بعد 3-4 أيام من ظهور المرض وتصل إلى الحد الأقصى من التتر بعد 2-3 أسابيع. وتقاس مدة المناعة النوعية المكتسبة بعد الإصابة بالأنفلونزا، خلافا للاعتقادات السابقة، بعدة عقود. تم التوصل إلى هذا الاستنتاج بناءً على دراسة التركيب العمري لحالات الإصابة بالأنفلونزا الناجمة عن فيروس A (H1N1) في عام 1977. وتبين أن هذا الفيروس، الذي غاب منذ عام 1957، يصيب فقط الأشخاص الذين تقل أعمارهم عن 20 عامًا في عام 1977. وهكذا، بعد الإصابة بعدوى الأنفلونزا الناجمة عن فيروس الأنفلونزا من النوع A، تتشكل مناعة شديدة، محددة بدقة للنوع الفرعي للفيروس (بواسطة مستضدات H و N) التي تسببت في تكوينه. بالإضافة إلى ذلك، يكون لدى الأطفال حديثي الولادة المناعة السلبية بسبب الأجسام المضادة IgG للنوع الفرعي للفيروس A. تستمر المناعة لمدة 6-8 أشهر.علم الأوبئة
مصدر العدوى هو المرضى وحاملي الفيروس. يحدث انتقال العامل الممرض عن طريق الرذاذ المحمول جوا. الأنفلونزا هي عدوى وبائية تحدث في كثير من الأحيان في أشهر الشتاء والشتاء والربيع. كل عشر سنوات تقريبًا، تتحول أوبئة الأنفلونزا إلى أوبئة تؤثر على سكان مختلف القارات. يتم تفسير ذلك من خلال التغير في مستضدات H و N للفيروس من النوع A المرتبط بانجراف المستضد والتحول. على سبيل المثال، تسبب فيروس الأنفلونزا A مع الراصة الدموية NSW1 في جائحة الأنفلونزا الإسبانية في عام 1918، والذي أودى بحياة 20 مليون إنسان. وفي عام 1957، تسبب فيروس الأنفلونزا "الآسيوي" (H2N2) في حدوث جائحة أصاب أكثر من ملياري شخص. في عام 1968، ظهر نوع جديد من الجائحة، وهو فيروس الأنفلونزا A (H3N2)، الذي يُسمى فيروس هونج كونج، والذي يستمر في الانتشار حتى يومنا هذا. وفي عام 1977، انضم إليه الفيروس من النوع A (H1N1). وكان هذا غير متوقع، حيث كان فيروس مماثل قد انتشر بالفعل في الفترة 1947-1957، ثم تم استبداله بالكامل بالنوع الفرعي "الآسيوي". وفي هذا الصدد، نشأت فرضية مفادها أن المتغيرات التحولية للفيروس ليست جديدة تاريخيا. إن توقف انتشار فيروس الأنفلونزا، الذي تسبب في الوباء التالي، يرجع إلى المناعة الجماعية للسكان التي تطورت إلى هذا المتغير المستضدي لمسببات المرض. على هذه الخلفية، هناك مجموعة مختارة من المتغيرات المستضدية الجديدة، التي لم تتشكل مناعة جماعية ضدها بعد. وليس من الواضح بعد أين تحول المتغيرات المستضدية (الأنواع المصلية) لفيروس الأنفلونزا A الذي خرج من الدورة النشطة في واحد أو يتم الحفاظ على فترة تاريخية أخرى لفترة طويلة. ومن الممكن أن يكون مستودع استمرار مثل هذه الفيروسات هو الحيوانات البرية والمنزلية، وخاصة الطيور، المصابة بالمتغيرات البشرية لفيروسات الأنفلونزا من النوع A وتحافظ على دورانها لفترة طويلة. وفي الوقت نفسه، تحدث عمليات إعادة التركيب الجيني بين فيروسات الطيور والفيروسات البشرية في أجسام الطيور، الأمر الذي يؤدي إلى تكوين متغيرات مستضدية جديدة. ووفقاً لفرضية أخرى، فإن فيروسات الأنفلونزا من كل الأنواع الفرعية المعروفة تنتشر بشكل مستمر بين السكان، ولكنها تصبح ذات صلة وبائية. فقط مع انخفاض في المناعة الجماعية، وتتميز فيروسات الأنفلونزا من النوعين B وC بثبات مستضدي أعلى. تسبب فيروسات الأنفلونزا B أوبئة وتفشيات محلية أقل حدة. يسبب فيروس الأنفلونزا من النوع C أمراضًا متفرقة، حيث يتم تدمير فيروس الأنفلونزا بسرعة بدرجات حرارة أعلى من 56 درجة مئوية، والأشعة فوق البنفسجية، والمطهرات، والمنظفات. ويظل قابلاً للحياة لمدة يوم واحد. في درجة حرارة الغرفة، على الأسطح المعدنية والبلاستيكية الملساء - لمدة تصل إلى يومين. تعيش فيروسات الأنفلونزا في درجات حرارة منخفضة (-70 درجة مئوية).الوقاية المحددة
للوقاية من الأنفلونزا، يتم استخدام الريمانتادين، الذي يمنع تكاثر فيروس الأنفلونزا من النوع A. للوقاية السلبية، يتم استخدام الغلوبولين المناعي البشري المضاد للأنفلونزا، الذي يتم الحصول عليه من مصل الدم للمتبرعين المحصنين بلقاح الأنفلونزا. إن إنترفيرون الكريات البيض البشرية له تأثير معين، وتستخدم اللقاحات الحية والمعطلة للوقاية من اللقاحات. عندما يتم إعطاء اللقاحات الحية، تتشكل المناعة العامة والمحلية. وبالإضافة إلى ذلك، لوحظ تحريض الإنترفيرون. وحاليا، تم الحصول على لقاحات معطلة من أنواع مختلفة: الفيروس، والوحدة الفرعية، والانقسام، والمختلط. يتم إنتاج لقاحات الفيروس عن طريق تنقية عالية الجودة للفيروسات المزروعة في أجنة الدجاج. لقاحات الوحدة الفرعية عبارة عن مستضدات سطحية منقاة لفيروس الأنفلونزا - الهيماجلوتينين والنورامينيداز. تتميز مستحضرات اللقاح هذه بانخفاض التفاعل وارتفاع المناعة. يتم تحضير اللقاحات المشقوقة أو المتفككة من معلق فيروسي منقى عن طريق المعالجة بالمنظفات. ومع ذلك، لا يوجد حتى الآن إجماع على تفوق أي من هذه اللقاحات. تحفز اللقاحات المعطلة استجابة مناعية في نظام المناعة الخلطية العامة والمحلية، ولكنها تحفز تخليق الإنترفيرون بدرجة أقل مقارنة باللقاحات الحية. تشير سنوات عديدة من الخبرة في استخدام اللقاحات الحية والمعطلة إلى عدم تطابق المستضدات في سلالات اللقاح مع إن الأمراض الوبائية هي السبب الرئيسي، ولكن ليس الوحيد، في انخفاض فعالية الوقاية من لقاح الأنفلونزا. في السنوات الأخيرة، جرت محاولات لإنشاء لقاحات الأنفلونزا المهندسة وراثيا والاصطناعية.أنفلونزا
الأنفلونزا مرض تنفسي حاد يصيب الإنسان ويميل إلى الانتشار بشكل وبائي. ويتميز بالتهاب نزفي في الجهاز التنفسي العلوي والحمى والتسمم العام الشديد. غالبا ما تكون الأنفلونزا مصحوبة بمضاعفات شديدة - الالتهاب الرئوي الجرثومي الثانوي، وتفاقم أمراض الرئة المزمنة. تنتمي مسببات أمراض الأنفلونزا إلى عائلة Orthomyxoviridae. ويشمل ثلاثة أنواع من الفيروسات - A، B، C. فيروس الأنفلونزا له شكل كروي، حجمه 80-120 نانومتر. في بعض الأحيان تتشكل الفيروسات الخيطية. يتكون الجينوم من RNA ناقص الجديلة، والذي يتكون من ثمانية أجزاء، ومحاط بقفيصة بروتينية. يرتبط الحمض النووي الريبي (RNA) بأربعة بروتينات داخلية: البروتينات النووية (NP) والبروتينات ذات الوزن الجزيئي العالي PI، P2، R3، المشاركة في نسخ الجينوم وتكاثر الفيروس. للقفيصة النووية نوع حلزوني من التماثل. توجد فوق غلاف القفيصة طبقة من بروتين المصفوفة (بروتين M). على الغلاف الخارجي فائق القفيصة، يوجد الهيماجلوتينين (H) والنورامينيداز (N) على شكل أشواك. كل من البروتينات السكرية (N وH) لها خصائص مستضدية واضحة. في فيروسات الأنفلونزا، تم العثور على 13 نوعًا مختلفًا من مستضدات الهيماجلوتينين (NI-13) و10 أنواع مختلفة من النيورامينيداز (N1-10). بناءً على مستضد البروتين النووي الداخلي، تم التمييز بين ثلاثة أنواع من فيروسات الأنفلونزا - A، B، C، والتي يمكن تحديدها في RSC. فيروسات النوع A التي تصيب البشر تحتوي على ثلاثة أنواع من الراصة الدموية (HI، H2، H3) واثنين من النورامينيداز (N1، N2). اعتمادًا على مجموعاتها، يتم تمييز أنواع مختلفة من فيروسات الأنفلونزا A - H1N1، H2N2، H3N2. يتم تحديدها في تفاعل تثبيط التراص الدموي مع الأمصال المناسبة.يمكن زراعة فيروسات الأنفلونزا بسهولة في أجنة الدجاج ومزارع الخلايا المختلفة. الحد الأقصى لتراكم الفيروسات يحدث بعد 2-3 أيام. في البيئة الخارجية، يفقد الفيروس قدرته على العدوى بسرعة من خلال الجفاف. في درجات حرارة منخفضة في الثلاجة، يتم تخزينه لمدة أسبوع، عند -70 درجة مئوية - لفترة أطول بكثير. يؤدي التسخين إلى تعطيله بعد بضع دقائق. تحت تأثير الأثير، الفينول، الفورمالديهايد، يتم تدميره بسرعة.طريقة التشخيص الفيروسي
مادة البحث هي مسحات من البلعوم الأنفي، وإفرازات الأنف، والتي تؤخذ بمسحات قطنية معقمة جافة أو مبللة في الأيام الأولى من المرض، والبلغم. يمكن العثور على الفيروسات في الدم والسائل النخاعي. في الحالات القاتلة يتم إزالة قطع من الأنسجة المصابة من الجهاز التنفسي العلوي والسفلي والدماغ وغيرها، ويتم أخذ مسحة من البلعوم الأنفي على معدة فارغة. يجب على المريض أن يتغرغر ثلاث مرات بمحلول ملحي معقم من كلوريد الصوديوم (10-15 مل) يتم جمعه في برطمان معقم واسع العنق. بعد ذلك، قم بمسح الجدار الخلفي للبلعوم والممرات الأنفية بقطعة من القطن المعقم، ثم اغمسها في مرطبان مع المضمضة، ويمكنك أخذ المادة بمسحة معقمة مبللة بمحلول كلوريد الصوديوم، والتي تستخدم في امسح الجدار الخلفي للبلعوم جيدًا. بعد جمع المادة، يتم غمر المسحة في أنبوب اختبار بمحلول فسيولوجي يضاف إليه 5% من مصل الحيوان المعطل. في المختبر، يتم شطف المسحات في السائل، وضغطها على جانب الأنبوب، وإزالتها. يُحفظ الصرف في الثلاجة حتى يستقر، ثم يُجمع الجزء الأوسط من السائل في أنابيب معقمة. تضاف المضادات الحيوية البنسلين (200-1000 وحدة دولية/مل)، والستربتوميسين (200-500 ميكروغرام/مل)، والنيستاتين (100-1000 وحدة دولية/مل) إلى المادة لتدمير البكتيريا المصاحبة، ويتم الاحتفاظ بها لمدة 30 دقيقة في درجة حرارة الغرفة وتستخدم لتدمير البكتيريا. عزل الفيروسات بعد فحصها مسبقا للعقم طريقة حساسة لعزل الفيروسات التي تصيب أجنة الدجاج بعمر 10-11 يوما. يتم حقن مادة بحجم 0.1-0.2 مل في التجويف الأمنيوسي أو السقاء. وكقاعدة عامة، يصاب 3-5 أجنة. يتم تحضين الأجنة عند درجة حرارة مثالية تتراوح بين 33-34 درجة مئوية لمدة 72 ساعة. ومن أجل زيادة عدد الفيروسات في مادة الاختبار، يتم تركيزها مسبقًا. وللقيام بذلك، يستخدمون طرق امتصاص الفيروسات على خلايا الدم الحمراء للدجاج، أو العلاج بمحلول التربسين 0.2% من أجل تعزيز الخصائص المعدية للفيروسات، أو ترسيبها باستخدام طرق خاصة. بعد الحضانة، يتم تبريد أجنة الدجاج في درجة حرارة منخفضة. درجة حرارة 4 درجات مئوية لمدة 2-4 ساعات، ثم يتم امتصاصها باستخدام ماصات معقمة أو حقنة أو السائل السقاء أو السائل الأمنيوسي. في هذه الحالة، يتم تحديد وجود فيروس معدي باستخدام RGA. للقيام بذلك، قم بخلط كميات متساوية (0.2 مل) من مادة مقاومة للفيروسات و1% معلق من خلايا الدم الحمراء للدجاج. تتم الإشارة إلى التفاعل الإيجابي (وجود فيروس في المادة) من خلال ترسيب كريات الدم الحمراء على شكل مظلة.إذا كان هناك فيروس في المادة له خصائص التصاق دموي، تتم معايرته باستخدام RGA الموسع، وتحديد عيار النشاط الدموي. باستخدام هذا التفاعل، يتم تحديد عيار فيروس التراص الدموي - وهو أعلى تخفيف للمادة التي لا تزال تنتج تفاعل التراص الدموي. يتم أخذ هذه الكمية من الفيروس كوحدة دموية واحدة (HAU).التعرف على فيروسات الأنفلونزا باستخدام RTGA
للقيام بذلك، قم أولاً بإعداد التخفيف العملي للمادة الفيروسية، التي تحتوي على 4 غاو من الفيروس في حجم معين، ويؤخذ التفاعل في الاعتبار بعد تكوين رواسب كريات الدم الحمراء في آبار التحكم. يتم الإشارة إلى رد الفعل الإيجابي من خلال تأخير التراص الدموي في آبار الاختبار.يمكن عزل فيروسات الأنفلونزا باستخدام خطوط زراعة الخلايا المختلفة - الجنين البشري، وكلية القرد، وخط خلايا الكلى المستمر للكلاب (MDCK) وغيرها. في مزارع الخلايا، يتجلى تأثير الفيروسات الخلوي (ظهور خلايا ذات حواف صدفية، فجوات، وتكوين شوائب داخل النواة والسيتوبلازم)، والذي ينتهي بانحطاط الطبقة الأحادية للخلية.للتعرف على الفيروسات المعزولة، يتم استخدام RTGA (بشرط أن يكون عيار الهيماجلوتينين في سائل الاستزراع 1:8 على الأقل). بالإضافة إلى هذا التفاعل، يمكنك استخدام RGGads، ومع ذلك، فهو أقل حساسية ويتطلب عيار مصل مناعي لا يقل عن 1:160 بالإضافة إلى RSK، RN، REMA، إلخ.دراسة مصلية
يستخدم الاختبار المصلي لتأكيد تشخيص الأنفلونزا. يعتمد على تحديد زيادة بمقدار أربعة أضعاف في عيار الأجسام المضادة في مصل المريض، يتم الحصول على المصل الأول عند بداية المرض في الفترة الحادة (2-5-1 أيام من المرض)، والثاني - بعد 10- اليوم الرابع عشر من المرض. نظرًا لأنه يمكن خلط الأمصال في نفس الوقت، يتم تخزين أولها في الثلاجة عند درجة حرارة -20 درجة مئوية. في أغلب الأحيان، يتم استخدام RTGA، RSK، RNGA. يتم تنفيذ هذه التفاعلات باستخدام مجموعات خاصة من التشخيصات الفيروسية القياسية (السلالات المرجعية لفيروس الأنفلونزا من مختلف الأنواع المصلية). نظرًا لأن أمصال المريض قد تحتوي على مثبطات التراص الدموي غير المحددة، يتم تسخينها أولاً عند درجة حرارة 56 درجة مئوية ويتم معالجتها أيضًا بإنزيم خاص (على سبيل المثال، النيورامينيداز) أو محاليل بريودات البوتاسيوم، والريفانول، وكلوريد المنغنيز، ومعلق الإطارات البيضاء، وما إلى ذلك. وفق مخططات خاصة. ورد فعل تثبيط التراص الدموي
يمكن إجراء تفاعل تثبيط التراص الدموي في أنابيب الاختبار (بضع الضخامة) أو في ألواح خاصة للدراسات المناعية، ويعتبر التفاعل إيجابيًا عند تكوين رواسب كثيفة ومتماسكة من خلايا الدم الحمراء ذات حواف ناعمة.التشخيص السريع
تعتمد الطريقة على تحديد مستضدات فيروسية محددة في مادة الاختبار باستخدام التألق المناعي في RIF المباشر أو غير المباشر. يتم الحصول على المخاط من الممرات الأنفية أو الجدار الخلفي للبلعوم، ويتم تحضيره بالطرد المركزي، ويتم تحضير المسحات على شرائح زجاجية من رواسب الخلايا الظهارية العمودية للغشاء المخاطي. يتم علاجهم بأمصال الفلورسنت المناعي المقترنة بالفلوروكروم، على سبيل المثال، FITC (إيزوثيوسيانات الفلورسين). عند فحص الأدوية باستخدام مجهر الفلورسنت، يلاحظ توهج مميز باللون الأخضر والأصفر لفيروسات الأنفلونزا، والتي يتم توطينها عند بداية المرض في نوى الخلايا الظهارية، ومؤخرًا، تم اقتراح استخدام ELISA وRZNGA وPCR للإشارة إلى مستضدات فيروسية محددة.الامتزاز
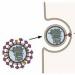
يرمز "H5N1" الشهير إلى "الهيماجلوتينين من النوع الخامس، والنورامينيداز من النوع الأول" - يلتصق هذان البروتينان على سطح فيروس الأنفلونزا (في الشكل 1، الهيماجلوتينين باللون الأخضر والنورامينيداز باللون الرمادي).
بمساعدة الهيماجلوتينين، يلتصق فيروس الأنفلونزا بالمستقبلات الموجودة على سطح الخلايا. الهدف الأولي للفيروس هو خلايا الظهارة الهدبية في الجهاز التنفسي، ولكن هذا ليس سبب حبنا له: يمكن أن يرتبط الهيماجلوتينين بمستقبلات العديد من الخلايا الأخرى، بما في ذلك خلايا الدم الحمراء. إذا ارتبط فيروس واحد بكريتين دم حمراء (متجاورتين) في نفس الوقت، فإن خلايا الدم الحمراء ستلتصق ببعضها البعض! ومن هنا اسم البروتين - "إلتصاق الدم".
أرز. 1
تطبيق
تمتص الخلية الغبية الفيروس الذي التصق بها عن طريق البلعمة - مثل أكلها. لماذا، لماذا يضع الأطفال دائمًا كل أنواع الأشياء السيئة في أفواههم؟! ومع ذلك، لا يزال الفيروس داخل الخلية كغذاء، داخل الحويصلة البلعمية (في الشكل 2 - "الجسيم الداخلي"). يندمج الإندوسوم مع الليزوزوم، وتتشكل فجوة هضمية، ويتم ضخ البروتونات فيها من السيتوبلازم لتكوين بيئة حمضية (تظهر هذه العملية في الشكل 2) - أكثر قليلاً، وسنقوم بهضم الفيروس (مع عبارة "الغذاء البروتيني، ما الفرق").

أرز. 2
يجرد
لكن الفيروس جاهز لهذا التحول في الأحداث:
 أرز. 3 |
- يتم تعديل الهيماجلوتينين تحت تأثير البيئة الحمضية - حيث يصبح سطحه محبًا للماء، وهو (الذي كان مرتبطًا سابقًا بالمستقبل على السطح الداخلي للغشاء الداخلي، الآن) مدمج داخل هذا الغشاء.
- تمر البروتونات التي يتم ضخها في الإندوسوم عبر بروتينات قناة خاصة (بروتينات M2، المشار إليها في الشكل 1 والشكل 3) عبر الغلاف الدهني للفيروس وتصل إلى الغلاف البروتيني للفيروس (في الشكل 1 - دائرة من الكرات البيضاء) -بروتينات M1) . ولهذا السبب، يتم تدمير غلاف البروتين (في الشكل 3، يُشار إلى بروتينات M1 الموجودة في غلاف البروتين المدمر على أنها نجوم حمراء).
- يندمج الغلاف الدهني للفيروس (بسبب اختراق الراصة الدموية) مع الغشاء (الدهني) للجسيم البلعمي؛ ينتهي الحمض النووي الريبي (RNA) للفيروس في سيتوبلازم الخلية.
استنساخ الفيروس
إن الحمض النووي الريبي (RNA) للفيروس الذي يتم إطلاقه في السيتوبلازم هو في حد ذاته آمن تمامًا.
- لا يمكن تصنيع البروتينات عليه، لأنه ناقص الحمض النووي الريبوزي (لا يتم تشفير البروتينات به، ولكن بواسطة الشريط الزائد التكميلي، وهو غير موجود بعد).
- ومن المستحيل أيضًا تصنيع الحمض النووي الريبي (RNA) عليه - فخلايانا عمومًا لا تحتوي على إنزيم قادر على مضاعفة الحمض النووي الريبي (RNA).
"أوه هو هو، ليس لديك أي شيء،" يتذمر فيروس الأنفلونزا، ويهز رأسه ذو الشارب، "لكن لا بأس، لقد أحضرت كل شيء معي." جلب الفيروس معه البروتينات PB1 وPB2 وPA، والتي تشكل معًا بوليميراز الحمض النووي الريبي المعتمد على الحمض النووي الريبي (RNA) الفيروسي - ويمكنه تكرار الحمض النووي الريبي (RNA). ولكن سوء الحظ! يحتاج أي بوليميراز إلى مادة تمهيدية لبدء العمل، لكن الأنفلونزا النسيان لم تأخذه معها! انتهى كل شئ؟!
اهدأ، لا داعي للذعر! - بهذه الكلمات يتم إرسال الشركة بأكملها (8 RNA فيروسي و 3 إنزيمات فيروسية) إلى نواة الخلية. هناك تحصل الأنفلونزا على الخدمة الكاملة:
- الاشعال لتكرار الحمض النووي الريبي الفيروسي (للحصول على الحمض النووي الريبي الزائد) هي أقسام مشقوقة من الحمض النووي الريبي الخلوي؛
- المعالجة: المقاطع التي كانت بمثابة الاشعال لتخليق الحمض النووي الريبي (RNA) - كانت هذه أغطية، لذلك تم إجراء تعديل النهاية 5 بوصة في البداية؛ وفي نهاية التوليف، يحدث التحلل المتعدد للنهاية 3 بوصة؛
- الربط: يتم تقطيع بعض الحمض النووي الريبي الفيروسي الذي يحتوي على معلومات عن بروتينين إلى جزأين.
بهذه الطريقة، يتم تصنيع RNAs الموجب، والذي يمكن أن يكون بمثابة قوالب لتخليق البروتينات الفيروسية وRNAs الفيروسية.
بعد ذلك، كل شيء بسيط: الخلية الغبية، باستخدام الريبوسومات الخاصة بها من الأحماض الأمينية الخاصة بها، تقوم بتصنيع بروتينات الفيروس، بما في ذلك بوليميراز الحمض النووي الريبي (RNA) المعتمد على الحمض النووي الريبي (RNA). يتم أيضًا إنتاج الأنفلونزا ناقص الحمض النووي الريبي (RNA) بقوة داخل النواة. يحدث تجميع الجزيئات الفيروسية في السيتوبلازم، على السطح الداخلي لغشاء الخلية. يترك الفيروس النهائي الخلية عن طريق الإخراج (التبرعم)، ويعض النورامينيداز الخيط الأخير الذي يربط الخلية بالفيروس الوليد... تظهر حياة صغيرة جديدة (شريرة) إلى العالم!

أرز. 4
K. SOLTISSEK وH.-D. كلينك (SN. شولتيسيك، إتش.-د. كلينك)
I. مقدمة
هناك عدد من المراجعات حول مشكلة تكاثر فيروس الأنفلونزا. تم تلخيص الأدبيات السابقة لعام 1968 في مقالات كتبها هويل (1968) وشولتيسيك (1969)؛ وتشمل الأعمال الأحدث مراجعات كتبها وايت (1973) وكومبانز وشوبان (1974).
تم الحصول على معظم البيانات المتعلقة بالتكاثر من دراسة فيروس الأنفلونزا من النوع A. ولم يتم العثور بعد على اختلافات كبيرة في آليات التكاثر للأنواع الأخرى من فيروسات الأنفلونزا.
أصبحت العديد من أنظمة زراعة الخلايا منتشرة على نطاق واسع وهي مناسبة لدراسة التكاثر، على سبيل المثال انتشار سلالة WSN من فيروس الأنفلونزا في خلايا MDBK (Choppin، 1969) أو انتشار فيروس طاعون الطيور (FPV) في الخلايا الليفية لجنين الدجاج. مثال على منحنى نمو آخر فيروس في دورة واحدة تم إثباته في 30، حيث تبلغ فترة الكمون حوالي 3 ساعات ويصل إنتاج الفيروس إلى هضبة تتراوح بين 8 و 12 ساعة، وبشكل عام، في مثل هذه الأنظمة الخلوية يكون العائد مرتفعًا لوحظ وجود فيروسات معدية، ويتم تثبيط تخليق البروتينات الخلوية بشكل فعال للغاية بعد الإصابة بالعدوى. ولذلك، فإن مثل هذه الأنظمة مريحة للغاية لأبحاث الكيمياء الحيوية.
ثانيا. الامتزاز والاختراق و"تجريد" الفيروس
تبدأ إصابة الخلية بالفيروس بالامتزاز، أي التصاق الجسيم الفيروسي بسطح الخلية. للارتباط، هناك حاجة إلى بنيتين متكاملتين، وهما: مواقع المستقبلات على سطح الخلية والمكون الفيروسي المسؤول عن التعرف على مواقع المستقبلات هذه.إن قدرة فيروس الأنفلونزا على التفاعل مع كريات الدم الحمراء من أصول مختلفة وتراصها معروفة منذ سنوات عديدة. (هيرست، 1941؛ ماكليلاند، هير، 1941) استُخدم التراص الدموي كتفاعل نموذجي لتفاعل فيروس الأنفلونزا مع سطح الخلية، و"معظم معرفتك بهذه الظاهرة تأتي من دراسات مماثلة. ومع ذلك، ينبغي للمرء أن يكون حذرا للغاية في التعميمات، لأن هياكل سطح كريات الدم الحمراء وسطح الخلايا المصابة يمكن أن تكون مختلفة تماما (انظر أيضا الفصل 3).
أ. دور الهيماجلوتينين في الامتزاز
مكون الفيريون المتورط في الارتباط هو HA* "السنبلة". تمت دراسة دور بروتينات بيتا الفيروسية في بدء العدوى باستخدام أجسام مضادة خاصة باثنين من البروتينات السطحية: HA* وNA*. يمكن الحصول على هذه الأجسام المضادة باستخدام الفيروسات المؤتلفة. على سبيل المثال، يؤدي التهجين بين فيروسات AO وA2 إلى تكوين X7F1 المؤتلف، الذي يحمل HA* وAO وNA* A2 (كيلبورن وآخرون، 1968). المصل المضاد لفيروس X7F1 لا يمنع NA* من فيروسات الأنفلونزا من النوع AO، ولكنه يمنع التراص الدموي ويحيد عدوى الفيروسات من هذا النوع. إن تفاعل نفس المصل مع فيروسات الأنفلونزا A2 لا يمنع التراص الدموي أو العدوى، على الرغم من اكتمال تحييد نشاط NA*. وبالتالي، NA* لا تشارك في عملية بدء العدوى، ويبدو أن NA* فقط هي المسؤولة عن الامتزاز. يتم دعم هذا المفهوم من خلال البيانات التي تفيد بأن الجزيئات الفيروسية التي تمت إزالة "مسامير" النيورامينيداز منها فقط بواسطة الإنزيمات المحللة للبروتين ظلت معدية (شولز، 1970).
هناك أدلة على أن الجزء المتراص للدم يتموضع على الجزء الخارجي من "السنبلة" HA*، وهي غنية بالكربوهيدرات (انظر الفصل 3). يبدو أن الكربوهيدرات ضرورية لوظيفة HA*، نظرًا لأن بروتينات HA* غير الجليكوزيلية غير قادرة على الارتباط بخلايا الدم الحمراء (Klenk et al., 1972b).
ب. مستقبل فيروس الأنفلونزا
تعتبر الكربوهيدرات مكونًا أساسيًا ليس فقط للهيماجلوتينين، ولكن أيضًا للمستقبل الفيروسي الموجود على سطح الخلية، وقد لاحظ هيرست (1942) أن مركب فيروس كريات الدم الحمراء غير مستقر وأن المستقبل الموجود على سطح الخلية يتم تدميره بواسطة إنزيم الفيروس. وكما ظهر لاحقًا، فإن هذا الإنزيم هو النيورامينيداز، الذي يفصل الحمض العصبي عن البروتينات السكرية (Klenk et al., 1955; Klenk, Stoffel, 1956; Gottschalk, 1957). كان هذا أول عرض للإنزيم الذي يعد جزءًا لا يتجزأ من جسيم فيروسي، كما أن النيورامينيداز البكتيرية قادرة على تدمير مستقبلات فيروس الأنفلونزا (بيرنت، ستون، 1947)، وهكذا وجد أن مستقبل فيروس الأنفلونزا هو بروتين سكري يحتوي على حمض النورامينيك.
ومنذ ذلك الحين، تم تجميع كمية كبيرة من المعلومات
حول مستقبلات الفيروس المخاطي، والتي تم تلخيصها مؤخرًا في المراجعة
هيوز (1973). يتم تلخيص البيانات التي تم الحصول عليها بإيجاز على النحو التالي:
نفخ تحتوي مناطق المستقبلات على بقايا الخلايا العصبية
حمض الإيويك، الموجود في سلاسل الكربوهيدرات
البروتينات السكرية. البقايا الطرفية غير المؤكسدة للخلايا العصبية
nosnla ضرورية لتفاعل البروتينات السكرية مع الفيروسات
انفلونزا روس. تتم إزالة العلاج بالنورامينيداز تمامًا
نشاط ملزم. دراسات التدهور مع هو
باستخدام فترة من المفترض أن للاتصال
يتطلب النشاط جزيء النورامين سليمًا
الأحماض (سوتاجيت ووينزلر، 1971). مجموعة الكربوكسيل،
وربما يلعب أيضا دورا هاما، لأنه ضروري
على ما يبدو، والقوى الكهروستاتيكية (هوانغ، 1974).
يبدو من المحتمل أنه لا يوجد سوى توابل ضعيفة
الجسدية بالنسبة للبنية التي ترتبط بها
حمض النيورامينيك، لأنه قد ثبت أنه كامل
مجموعة من البروتينات السكرية التي تحتوي على حمض الجايورامينيك،
يرتبط بالفيروسات المخاطية. علاوة على ذلك، فإن الغانغليوزيدات (gly-
تنشط في هذا الصدد (هايوود، 1975).
ومن المأمول أن تصبح مسألة ارتباط فيروس الأنفلونزا أكثر وضوحًا بمجرد إنشاء التركيب الجزيئي للمستقبل. وقد تم بالفعل تحقيق ذلك إلى حد ما في حالة كريات الدم الحمراء (مارتشيسي وآخرون، 1973). يمكن أيضًا توفير معلومات إضافية من خلال دراسة ارتباط الفيروسات المخاطية بالأغشية الاصطناعية (Tiffany and Blough، 1971).
ب. آليات الاختراق المحتملة و"التجريد"
تم اقتراح "آليتين مختلفتين للاختراق و"التعرية" ليس فقط لفيروس الأنفلونزا، ولكن أيضًا للفيروسات بشكل عام التي لها غلاف خارجي. وتعتمد وجهتا النظر بشكل أساسي على دراسات في الخندق الإلكتروني الدقيق. إحدى هذه الآليات هي يُعتقد أن الفيروس هو عملية تكاثر الخلايا، عندما يتم تضمين الجزيئات الفيروسية في البينوسومات، والتي تندمج لاحقًا مع الليزوزومات، وتتسبب إنزيمات الليزوزوم في "خلع ملابس" الفيروس (Fazekas de St. Grot، 1948). تم الحصول على وجهة النظر هذه في أعمال ديلز وشوبان (1962)، ودورماشكين وتيريل (1970). وبعد 10 دقائق من الإصابة، كانت الجزيئات الفيروسية مرئية في اتصال مباشر مع سطح الخلية، وبحلول 20 دقيقة كانت الجزيئات مرئية وجدت داخل الفجوات السيتوبلازمية. وعلى النقيض من هذه الدراسة التي أجراها مورغان وروز (1968) تشير إلى أن الدخول قد يكون نتيجة اندماج الغلاف الفيروسي مع غشاء الخلية المضيفة. ولذلك، لا يوجد حاليا أي إجماع بشأن آلية دخول فيروس الأنفلونزا.
كما هو موضح في الفصل. 5. تحتوي فيروسات فيروسات الأنفلونزا على بوليميراز RNA المرتبط بمكوناتها من البروتين النووي الريبي، ولذلك فمن غير المرجح أن تكون عملية “التعري” منفصلة مكانيا عن عملية إطلاق البروتين النووي الريبي، وتحدث هذه المرحلة على سطح الخلية، وفقا لآلية الغشاء. الاندماج، وفي الحويصلات البلعمية، وفقًا لآلية تآكل الفيروس.
ثالثا. النسخ أ. تسلسل تخليق الحمض النووي الريبي (RNA).
بعد "التعرية"، يجب نسخ sRNA الخاص بالفيريون إلى RNA المكمل. ويجب أن يعمل بوليميراز RNA الذي تم إدخاله مع الجسيم المُعدي في المرحلة الأولى من انتشار الفيروس (انظر الفصل 5). يمكن عزل جينوم فيروس الأنفلونزا من الفيروسات بشكلها فقط
شظايا منفصلة (انظر الفصل 6). علاوة على ذلك، فهو يعمل على شكل أجزاء منفصلة، كما أظهر التحليل الجيني (الفصل 7) والتعطيل التدريجي للفيروس المعدي (شولتيسيك، روت، 1964). وفي هذا الصدد، ينبغي الافتراض أن البوليميراز يبدأ عملية التوليف. الحمض النووي الريبوزي (RNA) في كل جزء فردي بما أن الحمض النووي الريبي (RNA) غير موجود في الخلية كجزيء حر، ولكنه يرتدي دائمًا بروتينًا، فإن السؤال الذي يطرح نفسه: ما هو البروتين الذي يرتبط به الحمض النووي الريبي (RNA) الفيروسي أثناء تكاثره؟
تمثل التجارب التي أجريت لدراسة تخليق الحمض النووي الريبي لفيروس الأنفلونزا صعوبات كبيرة، حيث لا يمكن استخدام الأكتينومايسين د للكشف عن إنتاج الحمض النووي الريبي الفيروسي عند تثبيط تخليق الحمض النووي الريبي الخلوي على وجه التحديد، لأن هذا المضاد الحيوي يمنع تكاثر فيروس الأنفلونزا ( باري وآخرون، 1962؛ روت، شولتيسيك، 1964؛ باري وآخرون، 1965؛ بونس، 1967). لهذا السبب، لتحديد التسلسل الزمني لتخليق الحمض النووي الريبي (RNA)، تم استخدام تهجين محدد للحمض النووي الريبي (RNA) المسمى بالنبض في نقاط مختلفة بعد الإصابة بفائض من vRNA غير المسمى أو vcRNA، متبوعًا بالعلاج باستخدام RNase (Scholtissek and Rott، 1970). في المراحل المبكرة من الدورة المعدية، ساد تخليق vcRNA، ووصل إلى الحد الأقصى تقريبًا في الساعة الثانية بعد الإصابة، بينما في المراحل اللاحقة، كان معظم الحمض النووي الريبي (RNA) الخاص بالفيروس الذي تم إنتاجه عبارة عن vRNA. كما أظهر كروج (1972)، باستخدام طريقة مختلفة، أنه بعد 4 ساعات من الإصابة، يتوقف تخليق BIKRNA بالكامل تقريبًا. بعد استخراج الفينول، تم اكتشاف كمية صغيرة نسبيًا من lncRNA (Scholtissek and Rott، 1970).
نظرًا لحقيقة أن نوعًا أو آخر من الحمض النووي الريبي الفيروسي يحتوي على معلومات 1 !! وظائفها وتستخدم كقالب لتخليق البروتينات الفيروسية (انظر القسم IVA)، قد يكون هناك بعض التحكم الترجمي على مستوى الهدم التفاضلي للحمض النووي الريبي الفيروسي. لذلك، تم إجراء تجارب مطاردة النبض لدراسة استقرار الحمض النووي الريبي (RNA) لفيروس الأنفلونزا في الجسم الحي. لقد ثبت أنه، على النقيض من الحمض النووي الريبي (RNA) الخلوي، فإن كلا النوعين من الحمض النووي الريبي (RNA) الفيروسي يكونان مستقرين تمامًا خلال فترة الـ 90 يومًا (Scholtissek et al., 1972).
في السابق، عند دراسة تخليق الحمض النووي الريبي الفيروسي في الجسم الحي، عندما تمت إضافة الأكتينوميسين D في المراحل المتأخرة من الدورة المعدية (Duesberg and Robinson، 1967؛ Nayak، 1970؛ Ma-hy، 1970)، لم يأخذوا في الاعتبار ذلك يمنع المضاد الحيوي على وجه التحديد تخليق الحمض النووي الريبي التكميلي في الجسم الحي (Scholtissek and Rott، 1970؛ Pons، 1973). نظرًا لأنه يتم إطلاق lncRNA من الخلايا المصابة في شكل خمس أجزاء منفصلة على الأقل، فقد تم استنتاج أن الحمض النووي الريبي الفيروسي يتم تصنيعه أيضًا في شكل أجزاء (بونس وهيرست، 1968).
ب. تحديد موقع تخليق الحمض النووي الريبي الفيروسي داخل الخلية المضيفة
من البيانات التي تم الحصول عليها عن طريق التصوير الشعاعي الذاتي، تم استنتاج أن موقع تخليق الحمض النووي الريبي الفيروسي يبدو أنه نواة الخلية (Scholtissek et al., 1962; Barry et al., 1974). وبما أن فترات النبض المستخدمة في هذه الدراسات كانت لا تزال طويلة جدًا، فلا يمكن استبعاد أن الحمض النووي الريبي الفيروسي يتم تصنيعه في سيتوبلازم الخلية ثم يتم نقله إلى النواة، حيث يمكن أن يتراكم. بالإضافة إلى ذلك، يمكن تصنيع vRNA وcRNA في أماكن مختلفة في الخلية.
ب. تثبيط تخليق الحمض النووي الريبي الفيروسي 1. الأكتيموميسين د والميثراميسين والأمانيتين
عند إضافة الأكتينومايسين D أو الميثراميسين، الذي يتداخل مع وظيفة قالب الحمض النووي، إلى الخلايا المصابة في الوقت الذي يكون فيه بوليميراز الحمض النووي الريبي (RNA) المعتمد على الحمض النووي الريبي (RNA) الفيروسي موجودًا بالفعل (على سبيل المثال، بعد ساعتين من الإصابة)، يستمر تصنيع vRNA لمدة ساعتين إضافيتين تقريبًا. ساعات، إلا أن إنتاج VcRNA يتوقف على الفور. لاحقًا ، يتناقص أيضًا تخليق الحمض النووي الريبي (vRNA) ، مما يشير إلى أنه يتطلب تكوينًا مستمرًا للـ vRNA (Rott et al.، 1965؛ Scholtissek and Rott، 1970؛ Scholtissek et al.، 1970؛ Pons، 1973). أظهر جريجورياديس (1970) أن الأكتينوميسين D له أيضًا تأثير قوي على تخليق الحمض النووي الريبوزي (vRNA) عند إضافته في وقت متأخر من دورة العدوى. في هذه التجارب، تم تحديد تخليق الحمض النووي الريبي الفيروسي من خلال الزيادة في دمج اليوريدين المسمى في إجمالي الحمض النووي الريبي للخلايا المصابة. يمكن التخلص من هذه الزيادة عن طريق إضافة الأكتينوميسين د. ومع ذلك، يجب أن يؤخذ في الاعتبار أن عدوى فيروس الأنفلونزا تسبب زيادة في دمج اليوريدين المسمى في الخلية بعد الإصابة (شولتيسيك وآخرون، 1967) وأن الأكتينوميسين د له تأثير مثبط على هذا الدمج (شولتيسيك وآخرون، 1967)..، 1969). يؤثر siAmanitin، الذي ليس له أي صلة بالحمض النووي، على نشاط أحد بوليميرات الحمض النووي الريبي (RNA podimerase II)، ويمنع أيضًا تخليق الحمض النووي الريبي النووي (cRNA) عند إضافته إلى سائل الاستزراع مباشرة بعد الإصابة (Rott and Scholtissek، 1970؛ Mahy et آل، 1972).
إن آلية تثبيط تخليق cfRNA بواسطة هذه المضادات الحيوية ليست واضحة تمامًا، لأنها لا تؤثر على تكوين cfRNA في المختبر، وبالتالي فإن هذه المضادات الحيوية تعمل فقط في الجسم الحي، على الرغم من أنه يمكن عزل الإنزيم الذي يصنع cfRNA من الخلايا التي يمكن عزلها من الخلايا. بعد ساعتين من الإصابة، تمت إضافة الأكتينوميسين D (Scholtissek and Rott، 1969a).
يمكن أيضًا قمع تكاثر فيروسات الأنفلونزا من خلال تأثيرات أخرى على الحمض النووي للخلية المضيفة - إدخال الميتومسين C، أو المعالجة المسبقة بالأشعة فوق البنفسجية، أو إزالة نوى الخلية قبل الإصابة (Barry، 1964؛ Rott et al.، 1965؛ Nayak، 2011). راسموسن، 1966؛ فول ليت وآخرون، 1974؛ كيلي وآخرون، 1974). إن الآلية التي تؤثر بها هذه التأثيرات على تكاثر فيروس الأنفلونزا قد تكون هي نفس آلية عمل المضادات الحيوية الأخرى، والافتراض الوحيد الذي يمكن استخلاصه من هذه الدراسات هو أن هناك حاجة إلى نواة خلايا نشطة "وظيفيًا" و (أو) في وظيفة الخلية المعتمدة على الحمض النووي لانتشار فيروسات الأنفلونزا. من المستحيل أن نقول ما هي هذه الوظائف.
2. سيكلوهيكسيميد
عندما تتم إضافة سيكلوهيكسيميد، الذي يثبط بشكل خاص تخليق البروتين في الخلايا الحيوانية، بعد ساعتين من الإصابة بفيروس الأنفلونزا، يتوقف تكوين vRNA على الفور، بينما يستمر تكوين vRNA لمدة ساعتين على الأقل (Scholtissek and Rott, 1970; Pons ، 1973). ليس من المعروف حتى الآن ما إذا كان التوليف المستمر للبروتين الفيروسي أو الخلوي المستخدم كعامل مساعد للجودة/العامل المساعد للبوليميراز الذي يصنع vRNA مطلوبًا، أو ما إذا كان بعض "البروتين (على سبيل المثال، بروتين NP) مطلوبًا لتثبيت vRNA المركب حديثًا، أو تثبيط تخليق بروتين فيروسي محدد يؤدي إلى التكوين المستمر للـ cRNA، والذي يتم إيقاف تخليقه عادة بعد 3 ساعات من الإصابة. وقد يكون هذا الإيقاف ضروريًا لتحفيز تخليق الحمض النووي الريبوزي vRNA. وينبغي للدراسات التي أجريت على الطفرات الحساسة لدرجة الحرارة أن تجيب على بعض هذه الأسئلة.
أظهرت التجارب التي أجراها Bean and Simpson (1973) أن النسخ الأولي في الجسم الحي (توليف cRNA على قالب RNA باستخدام بوليميراز الجسيم المصاب) لا يتم قمعه بواسطة سيكلوهيكسيميد، في حين يقوم الأكتينومايسين D بقمع النسخ تمامًا. وبالتالي، لا يؤثر سيكلوهيكسيميد في الجسم الحي على نشاط البوليميراز الذي يتم إدخاله مع الجسيم المعدي وتخليق cfRNA؛ ومع ذلك، فإنه يمنع تخليق بوليميراز جديد ضروري لإنتاج cfRNA.
3. الجلوكوزامين
من المعروف أن الجلوكوزامين يستنزف تجمع UTP في خلايا أجنة الدجاج عن طريق تكوين UTP-]M-acetylglucosamine (Scholtissek، 1971). عندما يتم استخدام محلول إيرل المحتوي على الجلوكوز كوسيط استنباتي، فإنه
له تأثير فقط على تخليق البروتينات الفيروسية (انظر القسم الخامس). ومع ذلك، إذا تم استبدال الجلوكوز كمصدر للطاقة بالليروفات أو الفوكوز، فإن استنزاف مجمع UTP بواسطة هذه السكريات الأمينية يحدث حوالي 10 مرات أكثر نشاطًا. في ظل هذه الظروف، يصبح تجمع UTP للخلية المضيفة محددًا محددًا لمعدل تخليق الحمض النووي الريبي (vRNA)، في حين أن تخليق الحمض النووي الريبي (RNA) الخلوي لم يتأثر بعد (Scholtissek، 1975).ونتيجة لقمع تخليق الحمض النووي الريبي الفيروسي، فإن تكوين البروتينات الفيروسية غائب أيضًا.
يمكن تفسير هذه البيانات بطريقتين: إما أن بوليميراز RNA الفيروسي المعتمد على الحمض النووي الريبي (RNA) له ألفة منخفضة لـ UTP مقارنة بالبوليميرات الخلوية المعتمدة على الحمض النووي و RIC، أو أن هناك مجموعتين مستقلتين أكثر أو أقل من UTP في الخلية، واحدة من والتي يمكن استخدامها لتخليق الحمض النووي الريبي الفيروسي وتتأثر بالجلوكوزامين أكثر من المجموعة الأخرى، والتي يمكن استخدامها كركيزة بواسطة بوليميرات الحمض النووي الريبي.
د. تخليق الحمض النووي الريبي الفيروسي في المختبر
في الخلايا المصابة بفيروس الأنفلونزا، اكتشف العديد من الباحثين بوليميريز الحمض النووي الريبي (RNA) المعتمد على الحمض النووي الريبي (Ho، Walters، 1966؛ Scholtissek، Rott، 1969a؛ Skehel، Burke، 1969؛ Ruck et al.، 1969؛ Mahy، Bromley، 1970؛ Compans، Caliguiri). ، 1973). تم العثور على معظم نشاط الإنزيم في الجزء الميكروسومي من الخلايا المصابة. في النظام المختبري، تتم إزالة هذا النشاط بواسطة RNase، ولكن ليس بواسطة DNAse. وهذا يعني أن القالب الداخلي هو RNA - يتطلب التفاعل وجود جميع نوكليوسيد ثلاثي الفوسفات الأربعة وهو حساس للأكتين-آيسين د. معظم إنتاج التفاعل في المختبر له وزن جزيئي منخفض نسبيًا. تشير بيانات Horisberger وGuskey (1973) إلى وجود نشاطين إنزيميين مختلفين في السيتوبلازم: أحدهما يعتمد على Mg++ ويتم تثبيته بواسطة تركيزات ملح عالية نسبيًا، والآخر يعتمد على Mn++ وأكثر مقاومة للملح. ويوجد نشاط الإنزيم الأخير أيضًا داخل الجسيم الفيروسي (انظر الفصل 5).
تم الحصول على نتائج متضاربة فيما يتعلق بمنتج الإنزيم السيتوبلازمي في النظام المختبري. روك ■ وآخرون. (1969) أفادوا أن هذا الإنزيم في أيديهم يصنع على الأقل "بعضًا من RNAs من نوع الفيريون (14 إلى 19S). توصل المؤلفون إلى هذا الاستنتاج عند تحديد التركيبة الأساسية للمنتج في نظام في المختبر بعد احتضان الميكروسومال جزء يحتوي على جميع نوكليوسيدات ثلاثي الفوسفات ذات العلامات الأربعة ذات النشاط الإشعاعي النوعي المعروف. ومع ذلك، فإن البيانات المستقاة من دراسة أقرب
لجيران حمض الأدينيليك، التي تم الحصول عليها في نفس العمل باستخدام [(a-32P]ATP، تتوافق مع بيانات تحليل الجيران الأقرب التي حصل عليها Scholtissek (1969)، والتي أدت إلى استنتاج مفاده أن المنتج في النظام المختبري له البنية من vcRNA. ذكر ماهي وبروملي (1970) في منشورهما الأصلي أيضًا أن جزءًا من المنتج في النظام المختبري الذي ينتجه إنزيم السيتوبلازم يجب أن يكون "vRNA". ومع ذلك، مؤخرًا هاستي وماهي (1973) في تحليل أقرب جيران وأكد التهجين النوعي تكوين الإنزيم السيتوبلازمي بشكل حصري تقريبًا من الحمض النووي الريبي النووي (cRNA)، كما أظهر لأول مرة بواسطة شولتيسيك (1969). قام كاليجويري وكومبانز (1973) أيضًا بعزل بوليميراز الحمض النووي الريبي (RNA) من سيتوبلازم الخلايا المصابة بفيروس الأنفلونزا، والذي قام بتصنيع الحمض النووي الريبي (RNA) في في النظام المختبري الذي يحتوي أقل من 90% منه على تسلسل أساسي مكمل للـ hsRNA.. وجد هاستي وماهي (1973) "أن نسبة كبيرة من المنتج في النظام المختبري الذي تم تصنيعه بواسطة الإنزيم النووي في وجود الأكتينومايسين د كان ليس من الواضح بعد ما هو نوع الحمض النووي الريبوزي (RNA) غير القادر على مثل هذا التهجين. القليل جدًا من الحمض النووي الريبي (RNA) المُصنَّع في ظل هذه الظروف يهجن مع الحمض النووي الريبوزي (ARNA) غير المسمى (شولتيسيك، بيانات غير منشورة).
يمكن تفسير حركية دمج GTP المسمى في الحمض النووي الريبي الفيروسي (RNA) الفيروسي على أنها تشير إلى عدم وجود إعادة بدء تخليق الحمض النووي الريبي (RNA) في النظام المختبري. إذا تم تحضين تحضير الإنزيم الخام بتركيزات منخفضة من الملح، فإن كل الحمض النووي الريبي المركب حديثًا يكون في البداية مفردًا. ومع ذلك، بعد الاستخلاص باستخدام الفينول، "تصبح نسبة كبيرة من الحمض النووي الريبي (RNA) مقاومة لـ RNAase. يحول الفينول بنية النسخ الوسيطة، التي تتكون من قالب مفرد الجديلة وحمض النووي الريبي النووي (cRNA) المركب حديثًا، والمتماسكين معًا في موقع النسخ بواسطة جزيء بوليميريز، إلى هيكل مزدوج تقطعت بهم السبل جزئيا (Feix et al.، 1967؛ Oberg، Philipson، 1971). يمكن تفسير هذه البيانات الخاصة بمنتج إنزيم فيروس الأنفلونزا في النظام المختبري على أنها تعني أن البوليميراز لا يبدأ البلمرة ويستمر فيها فحسب، بل إنه يفصل السلسلة المركبة حديثًا عن قالبها. بخلاف ذلك، يتم تشكيل بنية RNA مزدوجة الشريط، والتي ليس لها وظائف بيولوجية (Paffenholz and Scholtissek، 1973).إذا تم إجراء الحضانة بتركيزات عالية من الملح أو مع إنزيم منقى، فإن نسبة كبيرة من المنتج هي بالفعل RNA مزدوج الشريط. قبل استخلاص الفينول (شوارتز، شولتيسيك، 1973).
تم استغلال خاصية بوليميريز RNA لفيروس الأنفلونزا لتصنيع cfRNA حصريًا في نظام في المختبر.
يُدعى إلى إنشاء العلاقة الوراثية بين سلالات مختلفة من فيروس الأنفلونزا من خلال تحديد التماثل في التسلسل الأساسي بينها (Scholtissek، Rott، 1969b؛ Hobson، Scholtissek، 1970؛ Anschutz et al.، 1972).
رابعا. تخليق البروتينات الفيروسية
أ. الترجمة المختبرية
لم يتم حل مشكلة نوع الحمض النووي الريبوزي (RNA) الأيوني أو التكميلي – المفيد لتخليق البروتينات الفيروسية بعد. وقد تم الحصول على نتائج متضاربة فيما يتعلق بنوع الحمض النووي الريبي (RNA) الخاص بالفيروس والمرتبط بالجسيمات المتعددة. اكتشف ناياك (1970) تدرج السكروز في المنطقة المتعددة الجسيمات، بشكل رئيسي vRNA، بينما عزل بونس (1972) بشكل حصري vcRNA من polysa. تم تأكيد هذا الأخير من خلال الملاحظة أنه بعد إضافة الأكتينوميسين D، والذي يؤثر بشكل تفضيلي على تخليق vcRNA (انظر القسم III، B، (الشكل 1)، بعد ساعتين من الإصابة، لم يتم اكتشاف cfRNA في الجسيمات المتعددة للخلايا المصابة (بونس، 1973).
باستخدام نظام تخليق البروتين من الإشريكية القولونية وفيروس الأنفلونزا vRNA كقالب، اكتشف سيجيرت وآخرون (1973) تكوين بروتين NP الفيروسي في المختبر. وقد تميز هذا البروتين المسمى NP بالترسيب الهلامي باستخدام اختبار Ouchterlony. وعلى النقيض من ذلك، لم يلاحظ كينجسبري وويبستر (1973) أي تخليق للبروتين الفيروسي مع الحمض الريبي النووي النقال (vRNA) باستخدام نظام تخليق البروتين المشتق من الخلايا الشبكية في الأرانب. ومع ذلك، في نفس النظام، اكتشفوا تخليق بروتين M الفيروسي (om. الفصل 2) على الحمض النووي الريبي (RNA). القالب المعزول من الخلايا المصابة، وبالتالي، في الوقت الحالي، من المستحيل الإجابة على سؤال ما إذا كان الفيروس فقط أو مكمل فقط، أو ما إذا كانت بعض شظايا الحمض النووي الريبي (RNA) من نوع واحد وبعض شظايا الحمض النووي الريبي (RNA) من نوع آخر تستخدم كقوالب لتخليق البروتين. وفي الوقت الراهن، من الصعب على فيروسات الأنفلونزا أن تطبق تعريف السلسلة الفيروسية "السلبية" أو "الإيجابية"، كما اقترح بالتيمور (1971).
ب. تخليق البروتينات الفيروسية في الجسم الحي
يتم تسهيل دراسة تخليق "البروتينات" الفيروسية من خلال حقيقة أنه في الخلية المصابة يتم استبدال تخليق الببتيدات الخلوية بتوليف خاص بالفيروس. في الخلايا الليفية لجنين الدجاج المصابة بفيروس الورم الحليمي البشري (جوس وآخرون، 1969؛ سكيهيل، 1972؛ كلينك، روت، 1973)، وفي خلايا BHK 2IF المصابة بسلالة WSN من فيروس الأنفلونزا (لاسارويتز وآخرون، 1971)، ما يقرب من 4 ساعات بعد يتم تصنيع العدوى
البروتينات الفيروسية فقط (31). في وقت سابق إلى حد ما، لاحظ الباحثون تخليق ثلاثة أو أربعة ببتيدات في القراد المصابة (تايلور وآخرون، 1969؛ جوس وآخرون، 1969؛ هولاند، كين، 1970؛ وايت وآخرون، 1970). وفي وقت لاحق، تم اكتشاف عديدات ببتيدات أخرى (Lazorowitz et al., 1971; Skehel, 1972; Klenk et al., 1972b; Krug, Etkind, 1973). بشكل عام، تم اكتشاف جميع بروتينات بيتا الهيكلية في الخلايا المصابة: واحد أو اثنين من بروتينات P، والوحدة الفرعية NP، والبروتين الغشائي M، والبروتين السكري الهيماجلوتينيوم في الأشكال غير المشقوقة (HA) والمشقوق (HA1 وHA2)، والوحدة الفرعية NA .
بالإضافة إلى بروتينات الفيريون، تم وصف واحد أو اثنين من البروتينات غير البنيوية (NS).
هناك اختلافات ملحوظة<в уровнях синтеза отдельных вирусных полипептидов. NP- и NS-полипептиды обычно первыми обнаруживаются в зараженных «летках. Skehel (1973) предположил, что полипептиды Р2, NP и NS, которые первыми обнаруживаются в «клетках, зараженных ВЧП, являются
منتجات شظايا الحمض النووي الريبي (RNA) المتكونة أثناء النسخ الانتقائي بواسطة بوليميراز الفيريون لثلاثة أجزاء من الجينوم الفيروسي. عندما أصيبت الخلايا بوجود سيكلوهيكسيميد وأضيفت علامة النبض بعد إزالة المضاد الحيوي، تم اكتشاف هذه الببتيدات الثلاثة فقط. وبناءً على ذلك، كان من المفترض أن جزيئات الحمض النووي الريبي (RNA) لهذه المكونات قد تشكلت بمساعدة لوليميراز الفيريون المُدخل أثناء النسخ الأولي. من الساعة الرابعة إلى الساعة السادسة بعد إصابة الخلايا الليفية في الدجاج بفيروس الورم الحليمي البشري، يزداد مستوى تخليق البروتين M، وينخفض تخليق NS-loliliptide (Skehel، 1972، 1973). وبالتالي، يمكن التحكم في مستويات تخليق الإيوليبيبتيد بشكل فردي وقد تختلف خلال دورة النمو.
بصرف النظر عن انقسام ببتيد HA إلى HA1 و HA2، لا يوجد دليل على أن ببتيدات فيروس الأنفلونزا الخاصة بفيروسات الأنفلونزا يتم الحصول عليها نتيجة لانقسام سلائف كبيرة (تايلور وآخرون، 1969؛ لازارويتز وآخرون، 1971، سكيهيل) ، 1972؛ كلينك، روت، 1973).
تم الحصول مؤخرًا على معلومات جديدة بخصوص توطين المكونات الفيروسية في الخلايا المصابة باستخدام التصوير الشعاعي الذاتي (Becht، 1971) أو تجزئة الخلايا وتقنيات الفصل الكهربائي للهلام (Taylor et al.، 1969، 1970). ووفقا لهذه الدراسات، يبدو أن تخليق جميع البروتينات الفيروسية يحدث في السيتوبلازم. تم تفسير الدراسات السابقة لتوطين مستضد النوكليوتيدات عن طريق التألق المناعي على أنها تشير إلى أن التوليف يحدث في النواة مع إطلاق لاحق للمستضد في السيتوبلازم (Liu، 1955؛ Breitenfeld and Schafer، 1957؛ Holtermann et al.، 1960). ومع ذلك، فمن الواضح أن التألق المناعي يحدد تراكم المستضد، وليس تخليقه (انظر القسم الرابع، ب، 2).
1. بوليميريز الحمض النووي الريبي
يمكن اكتشاف نشاط بوليميريز الحمض النووي الريبي المعتمد على الحمض النووي الريبي (RNA) الخاص بالفيروسات في الخلايا المصابة بفيروس الأنفلونزا ما بين 13 و 3 ساعات بعد الإصابة، اعتمادًا على نظام الخلية المستخدم (Scholtissek and Rott، 1969a؛ Skehel and Burke، 1969؛ Ruck et al. آل، 1969؛ ماهي، بروملي، 1970). وهذا هو أول نشاط خاص بالفيروس يمكن اكتشافه بعد الإصابة. تم اكتشاف معظم نشاط اللوليميراز الفيروسي في الجزء الميكروسومي؛ ويبقى جزء من هذا النشاط في النواة ولا يمكن إزالته من هناك حتى عن طريق الغسيل المكثف. لا توجد اختلافات جوهرية في حركية التظاهر أو في العوامل المساعدة الضرورية بين الإنزيمات النووية والميكروسومي (Scholtissek and Rott, 1969a; Mahy et al., 1975).
عند مزيد من تجزئة السيتوبلازم في تدرج السكروز التدريجي باستخدام طريقة كاليجويري وتام (1970)، تم اكتشاف نشاط البلمرة في الأغشية الخشنة (كومبانز وكاليجويري، 1973؛ كلينك وآخرون، 1974 أ).
وبما أنه تم اكتشاف نشاط البوليميراز الفيروسي في جزيئات الفيروس المنقاة (انظر الفصل 5)، فإن السؤال الذي يطرح نفسه هو أي من البروتينات الفيروسية قد يرتبط به، وقد تمت تنقية البوليميراز المعزول من الخلايا المصابة بفيروس الأنفلونزا حوالي 200 مرة. كان المنتج الوحيد الخاص بالفيروس والمرتبط بنشاط البلمرة هو مستضد RNP (بروتين NP بالإضافة إلى الحمض النووي الريبي الفيروسي، الذي يتم تحديده بواسطة طريقة التثبيت التكميلي). أدت جميع المحاولات لإزالة الحمض النووي الريبي (RNA) من هذا المركب إلى فقدان كامل لنشاط الإنزيم (Schwarz and Scholtissek، 1973). تم طرح البروتين P كمرشح لدور البوليميراز الفيروسي (كيلبورن وآخرون، 1972). عندما تم عزل المركب الأنزيمي، الموسوم بالأحماض الأمينية في الجسم الحي، من الخلايا المصابة بفيروس الأنفلونزا وتنقيته حوالي 35 ضعفًا، كشف التحليل الكهربي في البداية عن HP-beloa فقط في هذا المركب< (Compans, Caliguiri, 1973). Впоследствии, однако, при других условиях введения;метки удалось обнаружить и Р-белок (Caliguiri, Compans, 1974). С другой стороны, Klenk и соавт. (1974) обнаружили Р-белок в цитоплазматическом золе, "который не обладает полимеразной активностью (Scholtissek, Rott, 1969a; Skehel, Burke, 1969). Эти наблюдения могут означать, что Р-белок осуществляет свою (Предполагаемую активность ферментов только при связывании с РНП-антигеном.
من غير المحتمل أن يكون لمستضد RNP نفسه نشاط بوليميريز، نظرًا لأن مصل فرط المناعة ضد مستضد RNP لا يمنع نشاط البوليميريز، في حين أن مصل النقاهة، الذي قد يحتوي على أجسام مضادة للبوليميريز، يفعل ذلك (Scholtissek et al., 1971). هذا المصل النقاهة (الذي تم الحصول عليه من الحيوانات المصابة بفيروسات الأنفلونزا A) يثبط نشاط البوليميريز لجميع سلالات فيروس الأنفلونزا A التي تمت دراستها، لكنه لم يثبط نشاط البوليميريز لفيروس الأنفلونزا B. كل هذه الملاحظات تتفق مع فكرة أن RNP- المستضد (BPHK + NP = البروتين)، يمكن أن يكون بمثابة قالب لتخليق cRNA-
2. بروتين القفيصة النووية
يرتبط بروتين NP بالـ RNA الفيروسي، مكونًا مستضد RNP. وهذا صحيح بالنسبة لبروتين NP المعزول ليس فقط من الفيريون، ولكن أيضًا من الخلية المصابة (Schafer, 1957). الوسائل المصلية، متى
حوالي 3 ساعات بعد الإصابة، وقبل ساعة من ظهور الراصة الدموية (بريتنفيلد، شيفر، 1957). بعد هذا الوقت، لا يزيد عيار مستضد RNP بشكل ملحوظ. قد يحدث هذا بسبب التوازن بين التوليف الجديد والدمج في الجزيئات الناضجة. من خلال وضع العلامات، يمكن اكتشاف بروتين NP في الخلايا المصابة خلال ساعتين بعد الإصابة (Scholtissek and Rott، 1961؛ Krug، 1972).
وبمساعدة الأجسام المضادة الفلورية، يتم اكتشاف مستضد RNP لأول مرة في النواة. يظهر لاحقًا في السيتوبلازم (Breitenfeld and Schafer، 1957). في ظل ظروف معينة، مثل العدوى المجهضة (فرانكلين، بريتنفيلد، 1959)، في وجود p-فلوروفينيل ألانين (زيمرمان، شيفر، 1960)، أو في ظل ظروف ظاهرة فون ماغنوس (روت، شولتيسيك، 1963)، مستضد RNP يبقى في النواة .
لا يعني التراكم المبكر لمستضد RNP في نوى الخلايا المصابة أن البروتين NP يتم تصنيعه أيضًا داخل النوى. تشير دراسات التصوير الشعاعي الذاتي، وكذلك استخدام طرق تجزئة الخلية، إلى التوليف السيتوبلازمي لهذا البروتين وبروتين آخر غني بالأرجينين ونقلهما السريع من السيتوبلازم إلى النواة (تايلور وآخرون، 1969، 1970؛ بيشت، 1971).
في مستخلصات الخلايا المصابة، يحتوي جزء معين من مستضد RNP على vRNA (Pons, 1971; Krug, 1972; Krug, Etkind, 1973)، على الرغم من وجود نوع واحد فقط من الحمض النووي الريبي (RNA) في الجزيئات الفيروسية (والذي يتبع عدم وجود أي نوع من الحمض النووي الريبوزي). التهجين الذاتي للـ vRNA) (Scholtissek، Rott، 1971؛ Pons، 1971). من المستحيل تحديد ما إذا كان مستضد RNP المحتوي على cfRNA له دور محدد في عملية الانتشار الفيروسي أم أنه مجرد قطعة أثرية تظهر أثناء عملية التجزئة الخلوية. وقد تبين أن كلا من خيوط الحمض النووي الريبي (RNA) ترتبط بشكل جيد على قدم المساواة ببروتين NP في المختبر (Scholtissek and Becht، 1971). وبالتالي، إذا كان هناك أي بروتين NP حر وcRNA حر، فسيتم تشكيل مستضد RNP المقابل على الفور أثناء عملية التجانس. يمكن إزاحة Virion RNA من مستضد RNP بواسطة البوليفين "Ilsulfate" M (Pons et al., 1969). لذلك، يمكن اختبار ما إذا كان استبدال RNAs الفيروسية المختلفة في مستضد RNP ممكنًا في المتجانسات الخلوية. من التغييرات في التركيبة الأساسية للحمض النووي الريبي الفيروسي المسمى لفترات زمنية مختلفة بـ 32P ومعزولًا عن مستضد RNP السيتوبلازمي، استنتج كروج (1972) أن بعض cfRNA، قبل دمجه في مستضد RNP، موجود في شكل حر. من NP- السنجاب. يحدث دمج 32P في الحمض النووي الريبي (RNA) للحويصلات الحيوانية مع مرحلة تأخر كبيرة بسبب الدمج البطيء إلى حد ما للفوسفور المسمى في الموضع x لنوكليوزيد ثلاثي الفوسفات (Scholtissek، 1965).حتى يتم إجراء التعديلات المناسبة لحسابات التغييرات في التركيب
لم يتم وضع أي أساس، وينبغي تفسير بيانات كروج (1972) بحذر.
يشير التحليل الحركي "لظهور مستضد RNP في النوى والسيتوبلازم" الذي أجراه كروج (1972) إلى أن مستضد RNP المتراكم في النواة ليس مقدمة لمستضد RNP الموجود في السيتوبلازم.
3. البروتينات غير الهيكلية
تم وصف العديد من البروتينات غير الهيكلية الخاصة بالفيروسات ذات الوظيفة غير المعروفة للخلايا المصابة. إحداها، ذات وزن جزيئي نسبي يبلغ 25000، والتي تتراكم بكميات كبيرة، تم تسميتها NS (لازارويتز وآخرون، 1971). في المواد الهلامية متعددة الأكريلاميد، يكون معدل هجرتها قريبًا من حركة البروتين M. ومع ذلك، يبدو أن كلا البروتينين مستقلان عن بعضهما البعض، كما يمكن رؤيته من الاختلافات في خرائط الببتيد الخاصة بهما، وتوجد كميات كبيرة من بروتين NS في النواة (Lazarowitz et al., 1971; Krug, Etkind, 1973). يتوافق مع بيانات دراسات التألق المناعي السابقة التي أجراها ديم موك (1969)، الذي لاحظ "تلطيخًا ساطعًا للنواة بمصل مضاد محدد للمستضدات الفيروسية غير الهيكلية، وربما يعكس هذا التلطيخ وجود بروتين NS. وقد وجد أيضًا أن هذا البروتين يكون البروتين الرئيسي الخاص بالفيروس في أجزاء من الريبوسومات الحرة والمرتبطة بالغشاء المعزولة من الخلايا المصابة (Pons، 1972؛ Compans، 1973؛ Klenk et al.، 1974a). يبدو أن ارتباط NS بالريبوسومات يعتمد على القوة النغمية (Krug and Etkind، 1973). في المخازن المؤقتة ذات القوة الأيونية المنخفضة، تم امتصاص هذا النوليبابتيد على كل من وحدات الريبوسوم الفرعية، بينما تمت إزالته منها عند إضافة الملح.
ألقت دراسة حديثة (جريجورياديس، 1973) بعض الشكوك حول تحديد NS باعتباره بولي ببتيد غير بنيوي يختلف عن متعدد ببتيد الفيريون M. وقد كان من الممكن استخلاص متعدد ببتيد M من الفيريون باستخدام الكلوروفورميثانول الحمضي، وبروتين. يمكن أيضًا استخلاص قابلية التنقل الكهربي المتماثلة من الخلايا المصابة بأكملها، أو النوى أو الجسيمات المتعددة. أدى تحليل منتجات المعالجة التريبتية لبروتين M، بالإضافة إلى البروتينات النووية والبروتينات المرتبطة بالريبوسوم، إلى العديد من التطابقات، مما يشير إلى أن M و بروتينات NS متطابقة، ولكن هناك حاجة لمزيد من المعلومات لتقديم تفسير مقنع لهذه النتائج.
بالإضافة إلى NS، قد تكون هناك مكونات أخرى غير بنيوية خاصة بالفيروسات، على الرغم من عدم وجود أي منها. لم يتم توصيفها بشكل كافٍ. استخدام المصل المضاد الموجه ضد المستضدات الفيروسية غير الهيكلية،
قام ديموك وواتسون (1969) بترسيب عديدات الببتيد ذات العلامات الإشعاعية من الخلايا المصابة. اقترح التحليل الكهربي في هلام بولي أكريلاميد وجود العديد من الببتيدات غير الهيكلية مع المكون الرئيسي المقابل لـ NS. يهاجر أحد المكونات غير الهيكلية المتبقية بسرعة أكبر وقد يتوافق مع مكون الوزن الجزيئي النسبي الذي يتراوح بين 10000 إلى 15000 والذي وصفه سكيهيل (1972) وكروج وإتكيند (1973).
4. بروتين الغشاء M
يوجد بروتين M، الذي يبطن السطح الداخلي للطبقة الدهنية الثنائية للغلاف وهو غني بالفيريون، بكميات صغيرة نسبيًا في الخلايا المصابة، وهذا لا يشير فقط إلى إمكانية التحكم في تخليق بروتين M، ولكن أيضًا إلى احتمالية أن هذا البروتين التخليق هو مرحلة الحد من معدل تكاثر الفيروس (Lazarowitz et al., 1971) ويدعم هذا المفهوم البيانات التي تفيد أنه عند درجة حرارة 29 درجة مئوية، حيث يتم قمع إنتاج الفيروس، يكون بروتين M هو البروتين الوحيد الخاص بالفيروس. البروتين الذي لا يمكن اكتشافه في الخلايا المصابة (Klenk، Rott، 1973).
بروتين M (يمكن العثور عليه على الأغشية الملساء والبلازما للخلايا المصابة (Lazarowitz et al., 1971; Cornpans, 1973a; Klenk et al., 1974a). تشير هذه البيانات إلى تقارب هذا البروتين للأغشية.
5. الهيماجلوتينين
يتم تصنيع الهيماجلوتينين كبروتين سكري كبير - مقدمة لـ HA، والذي ينقسم لاحقًا إلى بروتينين سكريين أصغر: HAi و HA2 "(Lazarowitz et al.، 1971). الانقسام، الذي يمكن قمعه بواسطة مثبطات الأنزيم البروتيني (Klenk، Rott، 1973). ) ، يتم تنفيذه على ما يبدو عن طريق الإنزيمات المحللة للبروتين في الخلية المضيفة (لازارويتز وآخرون، 1973). وتعتمد درجة الانقسام على سلالة الفيروس، والخلية المضيفة، ومستوى التأثير السام للخلايا ووجود أو عدم وجود المصل في الوسط (Lazarowitz et al., 1971, 1973a, b ; Klenk, Rott, 1973; Stanley et al., 1973). وهكذا، فإن WSN المزروع في مزرعة الخلايا الليفية في أجنة الكتكوت يحتوي فقط على بروتينات الهيماغلوتينين الجليش المشقوقة، في حين أن مثل هذه البروتينات يكون الانقسام غائبًا تقريبًا إذا نمت فيروسات WSN في خلايا MDBK في مصل الغياب، ومع ذلك، في وجود المصل، ينشق هيماجلوتينين WSN أيضًا.
يحدث النظام على غشاء البلازما (Lazaro-witz et al.، 1973a). في نظام VChP، تبدو آلية هذا الانقسام مختلفة. يحدث الانقسام "في الأغشية داخل الخلايا، والبلازمينوجين في هذه الحالة ليس ضروريًا" (Shchepk et al., 1974a). تنخفض درجة الانقسام بشكل حاد عند 25 درجة مئوية (Klenk and Rott، 1973).
لا يعد انقسام HA شرطًا لنشاط التراص الدموي أو تجميع الفيروس (La-zarowitz et al., 1973a; Stanley et al., 1973)، لكن الدراسات الحديثة وجدت أنه مطلوب للعدوى (Klenk et al., 1975b). تتوافق هذه البيانات مع الفرضية القائلة بأنه بالإضافة إلى دوره في الامتزاز، فإن HA* له وظيفة أخرى في عملية العدوى وأن التحلل ضروري لهذه الوظيفة. وعلى أساس أن تحلل HA هو ظاهرة تعتمد على "الخلية المضيفة" ، وأن الجسيمات التي تحتوي على HA غير مشقوق منخفضة العدوى، تشير إلى أن نطاق المضيف وانتشار عدوى فيروس الأنفلونزا يعتمد على وجود بروتياز الخلية المضيفة باعتباره إنزيمًا منشطًا.
في التجارب على تجزئة "الكريات المصابة بالسادس
أنفلونزا روس، وجد أن البروتينات السكرية HA موجودة دائمًا
ترتبط بالأغشية (Compans، 1973a؛ Klenk et al.،.
1974 أ). التوطين داخل الخلايا لهذه البروتينات ولحظتها
جهاز اتصال لاسلكي من الأغشية الخشنة إلى الأغشية الإندوبلازمية الملساء
سيتم إزالة شبكية السماء وأغشية البلازما
تم وصفها بالتفصيل في القسم السابع، ب. .,
6. النورامينيداز
تم اكتشاف NA* الفيروسي باعتباره إنزيمًا نشطًا
بعد 3 ساعات من الإصابة في الغشاء السقاء المشيمي
ناه، وبالاستقراء ثبت أن بداية تركيبه
تحدث الأطروحة بعد 1-2 ساعة من الإصابة (Noll et al.,
1961). تمت دراسة التوطين داخل الخلايا لـ NA * باستخدام
ثم تجزئة الخلايا، ووجدت أنها على ما يبدو
mu، يشبه توطين HA* (Compans، 1973a؛ Klenk et al.،
1974 أ). تم العثور على NA* بالارتباط مع الأغشية،
تم الحصول عليها من الشبكة الإندوبلازمية الملساء،
عند تحديده عن طريق النشاط البيولوجي والتحليل
zu في هلام بوليازريلاميد. كان نشاط الانزيم مرتفعا
dena أيضًا في الأجزاء التي تحتوي على أغشية خشنة
نحن. وتتوافق هذه البيانات مع البيانات التي تم الحصول عليها من
التألق المناعي (ماينو، كيلبورن، 1970). بعد 4 ساعات
بعد الإصابة، يمكن الكشف عن النورامينيداز في السيتوبلازم
بلازما؛ في وقت لاحق يبدو أنها تركز على بيري
فيريا الخلية.
V. تركيب الكربوهيدرات
تشارك الكربوهيدرات في تكوين البروتينات السكرية والجليكوليدات في غلاف فيروس الأنفلونزا (Klenk et al.، 1972a). الجليكوليبيدات من الفيروسات المخاطية (أصلها من أغشية البلازما للخلية المضيفة (Klenk، Choppin، 1970)، ولكن لم يتم تحديد أي منها يتم تضمينه في الغالب في الفيريون: الجليكوليبيدات الموجودة مسبقًا أو المصنعة حديثًا.
أظهر استخدام السلائف المشعة مثل الجلوكوزامين والمانوز والجلاكتوز والفوكوز، والتي يتم دمجها بشكل خاص في الجلوكوبيلتيدات الفيروسية، أن السلاسل الجانبية للكربوهيدرات لهذه الجليكوبيبتيدات يتم إعادة تصنيعها أثناء العدوى (Haslam et al., 1970; Cornpans et al., 1970 أ؛ شوارتز وكلينك، 1974). قدمت تجارب تجزئة الخلايا معلومات إضافية حول مواقع الارتباط بالجليكوزيل للبروتينات السكرية الفيروسية، ويرتبط الجلوكوزامين مع بولي ببتيد HA في كل من أجزاء الغشاء السيتوبلازمي الناعم والخشن، ومع ذلك، يرتبط الفوكوز بـ HA في الأغشية الملساء ولكن ليست الخشنة (كومبانز، 1973 ب). .يؤدي تثبيط تخليق البروتين باستخدام البيوروميسين إلى إيقاف دمج الجلوكوزامين على الفور تقريبًا، بينما يستمر دمج الفوكوز لمدة 10-15 دقيقة تقريبًا (ستانلي وآخرون، 1973). وأخيرًا، في FPV، يكون البروتين السكري هو مقدمة HA والانقسام. منتجات حاج<и НА2 содержат, по-видимому, полный состав маннозы « глюкозамина, тогда как содержание фукозы и галактозы значительно выше в продуктах расщепления (Klenk et al., 1975a; Schwarz, Klenk, 1974). Эта наблюдения предполагают, что биосинтез углеводных боковых целей гликопротеинов НА осуществляется по стадиям с различными остатками Сахаров, добавляемыми в разных участках клетки. Глюкозамин и манноза (присоединяются, по-видимому, к полипептидам НА на шероховатых мембранах вскоре после или даже в процессе синтеза поляпептида, в то время как фукоза, вероятно, прикрепляется позже с помощью трансфераз, присутствующих в гладких мембранах.
من المحتمل أن تكون ناقلات الجليكوزيل هذه عبارة عن إنزيمات خلوية. لذلك، يبدو أن الكربوهيدرات (جزء من البروتينات السكرية) يتم تحديدها بواسطة الخلية المضيفة. ومع ذلك، هناك أدلة على أنه بالإضافة إلى إنزيمات الخلية المضيفة، تلعب NA* الفيروسية دورًا مهمًا في تكوين السلاسل الجانبية للكربوهيدرات. أثبت أن سطح أغلفة الفيروسات الفطرية يفتقر إلى حمض النورامينيك (Klenk, Choppin, 1970b; Klenk et al., 1970)، بينما في الأصداف الفيروسية التي لا تحتوي على هذا الإنزيم، تكون هذه الكربوهيدرات مكونًا شائعًا (Klenk, Choppin, 1971). ؛ ماكشاري، فاغنر، 1971؛ رينكونن وآخرون، 1971) تشير هذه البيانات إلى أن
يعد تأثير حمض النورامينيك سمة أساسية للفيروسات المخاطية. لقد ظهر مؤخرًا أن NA* مسؤول عن إزالة حمض النورامينيك من غلاف فيروس الأنفلونزا، وبالتالي منع تكوين المستقبلات على الغلاف الفيروسي الذي قد يؤدي لولا ذلك إلى تكوين تجمعات كبيرة من الجزيئات الفيروسية (باليس وآخرون، 1974). تدعم هذه البيانات المفهوم القائل بأن الجزء الكربوهيدراتي من NA*، باعتباره البروتين السكري السطحي الرئيسي، هو نتاج العمل المشترك لـ (الترانسفيراز الخلوي والـ NA* الفيروسي. وبفضل تأثيره، يكون الفيروس قادرًا على إدخال فيروس- تعديل محدد إلى (في البداية، بنية معقدة خاصة بالمضيف لتعديل الكربوهيدرات، والتي، وفقًا لـ - ضرورية على ما يبدو للنشاط البيولوجي للفيروس.
يمنع D-glucosamine و 2-deoxy-O-glucose تكوين HA * و NA * النشط بيولوجيًا والفيروسات المعدية (Kilbourne، 1959؛ Kaluza et al.، 1972). كشفت الدراسات البيوكيميائية أن هذه السكريات تتنافس مع التخليق الحيوي للبروتينات السكرية الفيروسية (غاندي وآخرون، 1972؛ كلينك وآخرون، 1972ب). في وجود هذه المثبطات، يتناقص حجم البروتين السكري NA، وتعتمد درجة التخفيض على الجرعة، وبالتالي، مع زيادة تركيز السكر، يتحول البروتين السكري NA ذو الوزن الجزيئي النسبي 76000 تدريجياً إلى مركب ذو وزن جزيئي نسبي 76000. الوزن الجزيئي قدره 64000، والذي تم تحديده كـ HA0 (Klenk et al.، 1972b; Schwarz and Klenk، 1974). إن التحول في الوزن الجزيئي يوازي الانخفاض في محتوى الكربوهيدرات ووجد أن بروتين HA0 خالٍ تقريبًا من الكربوهيدرات (Schwarz و Klenk، 1974). تشير هذه النتائج إلى أن HA0 عبارة عن سلسلة ببتيد غير كاملة الغليكوزيلات أو "سلسلة عديد الببتيد الغليكوزيلاتي من البروتين السكري HA وأن التأثير المثبط لـ D-glucose amine a و2-deoxy-O-glucose يرجع إلى تلف الغليكوزيل. يرتبط عديد الببتيد HA0 بالأغشية، مثل HA الطبيعي، ويهاجر أيضًا من الشبكة الخشنة إلى الشبكة الملساء، حيث ينقسم إلى عديد ببتيد HA01 وHA02، لذلك ربما لا تكون الكربوهيدرات ضرورية لتقارب هذا الببتيد للغشاء. ومع ذلك، فإن غياب نشاط التراص الدموي في الخلايا المصابة يشير إلى أن البروتين غير الغليكوزيلاتي غير قادر على الارتباط بالمستقبلات.
السادس. تخليق الدهون
مثل جميع الفيروسات المغلفة، يكتسب فيروس الأنفلونزا الدهون الخاصة به عن طريق إعادة تدوير الدهون في الخلايا المضيفة. ويؤكد هذا الموقف الملاحظات التالية:
دينيا. وجد أن التركيبة الدهنية لفيروس الأنفلونزا مشابهة لتلك الموجودة في الخلية المضيفة (Ambruster and Beiss، 1958؛ Frommhagen et al.، 1959). يتم دمج دهون الخلية المضيفة، التي تم تصنيفها إشعاعيًا قبل الإصابة، في جزيئات فيروسية (ويكر، 1957). عندما ينمو الفيروس في خلايا مضيفة مختلفة، يتم اكتشاف تعديلات في الدهون الفيروسية (Kates et al., 1961, 1962). بشكل عام، تعكس دهون الفيروسات (التي تتبرعم من سطح الخلية، بشكل وثيق التركيب الدهني للغشاء البلازمي للخلية المضيفة (Klenk, Choppin, 1969; 1970a, b; Renko-nen et al., 1971). ظل مستوى تخليق دي نوفو الفوسفوليلد في الخلايا الليفية لجنين الكتكوت دون تغيير لمدة 7 ساعات بعد الإصابة بفيروس الأنفلونزا، وبعد ذلك تم تثبيط تخليق الدهون بالكامل (Blough et al., 1973). ربما لا يكون هذا القمع تأثيرًا أساسيًا، ولكنه قد يكون تكون ثانوية فيما يتعلق بتثبيط تخليق الحمض النووي الريبوزي (RNA) أو البروتين أو "التأثيرات البيولوجية الأخرى".
وهكذا، بناءً على النتائج التي تم الحصول عليها حتى الآن، يمكن الافتراض أن تخليق الدهون الفيروسية يحدث من خلال عمليات التخليق الحيوي للدهون الخلوية الطبيعية، ويتكون الغلاف الفيروسي من خلال دمج الدهون من غشاء البلازما للخلية المضيفة.
سابعا. التجميع (انظر أيضًا الفصل الثاني)
أ. تكوين الكابسيدات النووية
كما ذكرنا سابقًا، فمن المرجح أن يتم تصنيع بروتين القفيصة النووية في السيتوبلازم. على ما يبدو، فإنه موجود هناك لفترة قصيرة في شكل حر، ثم يرتبط مع الحمض النووي الريبي الفيروسي، وتشكيل القفيصات النووية (Klenk et al.، 1974؛ Compans and Caliguiri، 1973). نظرًا لأن بروتين NP يتم دمجه بسرعة في اليوكليوكابسيدات، فيمكن اختيار الحمض النووي الريبي (RNA) من المجموعة المُعاد تشكيلها (كروج، 1972). نظرًا لصغر حجم القفيصات النووية لفيروس الأنفلونزا، لا يمكن تحديدها بدقة في الخلايا المصابة باستخدام المجهر الإلكتروني. مجموعات من الخيوط أو الألياف التي يبلغ قطرها حوالي 5 نانومتر والتي لوحظت في السيتوبلازم ربما تمثل البروتينات النووية الفيروسية (Apostolov et al.، 1970؛ Compans et al.، 1970b).
تشير البيانات المتاحة إلى أن جينوم الحمض النووي الريبي لفيروسات الأنفلونزا يتكون من 5-7 أجزاء (انظر الفصل 6).
لذلك، يحتاج أي جسيم معدي إلى نسخة واحدة على الأقل من كل جزء. هيرست (1962) قبل-
افترض أنه يمكن تضمين القفيصات النووية من التجمع داخل الخلايا في (الفيروسات بشكل عشوائي. يمكن زيادة نسبة الفيروسات المعدية في المجموعة E عن طريق تضمين أجزاء إضافية من الحمض النووي الريبي (RNA) في الفيريون المتوسط (Compans et al., 1970). على سبيل المثال، إذا كانت خمسة مطلوبة لشظايا الحمض النووي الريبي (RNA) المختلفة المعدية، حيث تحتوي كل فيرنوي على إجمالي 7 شظايا متضمنة في فيرنوي بشكل عشوائي، ثم يجب أن يكون ما يقرب من 22٪ من الفيروسات معدية. تم تعزيز الدليل على التضمين العشوائي لشظايا الحمض النووي الريبي (RNA) من خلال الملاحظات الأخيرة لهيرست ( 1973) أنه في التجمعات الفيروسية، تحدث إعادة التركيب بين الجسيمات التي لا تشكل لويحات. يمكن تفسير قدرة هذه الجسيمات على المشاركة في إعادة التركيب بغياب جزء واحد أو أكثر في الجزيئات، مع اختلاف الأجزاء المفقودة من جسيم واحد إلى أخرى، بحيث يمكن للجسيمات المناسبة من الفيروس المعيب أن تشكل مواد مؤتلفة.
ب. عملية ربط الفيروسات
مثل معظم الفيروسات المغلفة، يتجمع فيروس الأنفلونزا على أغشية الخلايا المتشكلة مسبقًا؛ يحدث التجميع عن طريق التبرعم من غشاء البلازما. تم تقديم العرض الأول لإطلاق الفيروس من الخلية من خلال عملية لا تتضمن التحلل بواسطة ميرفي وبانج (1952) في دراسات المجهر الإلكتروني المبكرة للخلايا المصابة بفيروس الأنفلونزا.الهياكل الخيطية والكروية. لم تكن جزيئات الفيروس مرئية داخل الخلايا أثناء تكوين الفيروس المعدي، وبالتالي كان من الواضح أن جزيئات الفيروس كانت تتشكل على سطح الخلية. وباستخدام الأجسام المضادة التي تحمل علامة الفيريتين، لاحظ مورجان وآخرون (1961) أن سطح الخلية يحتوي على فيروسات المستضد في المناطق التي يتشكل فيها الفيروس، وأظهرت الدراسات المجهرية الإلكترونية اللاحقة أن سطح الفيروس الناشئ يحتوي على نفس غشاء الخلية المضيفة مع طبقة من النتوءات المقابلة لـ "نتوءات" الفيروس على السطح الخارجي. توجد على سطح الغشاء الفيروسي طبقة إضافية كثيفة الإلكترون غائبة على سطح الخلية، والتي ربما تتكون من M-olipeptides (Bachi et al.، 1969؛ Compans، Dimmock، 1969؛ Apostolov et al.، 1970).
وقد أعطت دراسات المجهر الإلكتروني أسبابًا لاقتراح الترتيب الذي تتبعه المكونات الفيروسية في المادة:
يرتبط على غشاء الخلية (Bachi et al.، 1961؛ Compans and Dimmock، 1969؛ Compans et al.، 1970b).
تظهر بروتينات الغلاف الفيروسي أولاً، حيث يتم تضمينها في بعض مناطق الغشاء التي يجب أن يكون لها شكل طبيعي؛ ومع ذلك، فإن الامتزاز النوعي الملحوظ لكريات الدم الحمراء في هذه المناطق من الغشاء يشير إلى وجود بروتين HA هنا. ومن ثم، على ما يبدو، يرتبط البروتين M بالسطح الداخلي لمثل هذه المناطق من الغشاء، مكونًا طبقة كثيفة الإلكترونات. بعد ذلك، يرتبط البروتين النووي الريبي على وجه التحديد بالغشاء في هذه المناطق وتحدث عملية التبرعم عن طريق ثني الغشاء وبروزه. الجزء المحيط بالبروتين النووي المرتبط به، كما تدعم بيانات الترحيل الكهربائي للهلام متعدد الأكريلاميد فكرة أن بروتينات الغلاف ترتبط بغشاء البلازما بسرعة أكبر من RNPs (Lazarowitz et al., 1971). يتم إزاحة ببتيدات الخلية المضيفة من الغشاء، وهو مقدمة لـ RNPs الغلاف الفيروسي، حيث أن مثل هذه الببتيدات لا توجد في الفيروسات النقية. كما ذكرنا سابقًا، فإن بقايا حمض النورامينيك غائبة عن غلاف جزيئات فيروس الأنفلونزا الناشئة، ولكنها موجودة في المناطق المجاورة من غشاء الخلية (Klenk et al., 1970). .
توفر هذه البيانات دليلاً على التحول الدراماتيكي في التركيب الكيميائي بين غلاف الجسيم الفيروسي الناشئ وغشاء الخلية المجاور.
ومع ذلك، من ناحية أخرى، فإن إحدى السمات المهمة لعملية التبرعم هي أن الغلاف الفيروسي مستمر مع الغشاء البلازمي للخلية المضيفة ويشبهه من الناحية الشكلية (Compans and Dimmock, 1969). وكما ذكرنا سابقًا، فإن الدهون الموجودة في هذه الأغشية تشبه إلى حد كبير الدهون الموجودة في غشاء الخلية المضيفة. تشير هذه الملاحظات إلى أن الدهون الموجودة في غشاء البلازما السليم تتبادل بسهولة مع الدهون الموجودة في جزيئات الفيروس الناشئة عن طريق الانتشار الشعاعي.
وبالتالي، يتكون غلاف الفيريون الناشئ من منطقة صغيرة من غشاء الخلية المعدلة عن طريق تضمين بروتينات غلاف الفيريون. هذا المفهوم، بطبيعة الحال، لا يعني الحاجة إلى تخليق جميع مكونات الغشاء في غشاء البلازما.
في الواقع، كان من المعروف منذ زمن طويل أن مكونات الغشاء يجب أن تهاجر مسافات كبيرة من جزء من الخلية إلى جزء آخر من أجل الانتقال من موقع تخليقها الحيوي إلى موقع تجميع الغشاء. أظهر بريتنيلد وشيفر (1957) أنه في الخلايا المصابة بفيروس الأنفلونزا، يمكن رؤية HA* لأول مرة
تحدث في جميع أجزاء الخلية وأنها موضعية في المنطقة المحيطة بالنواة بتركيز متزايد. لاحقًا، يتراكم HA* في "المنطقة المحيطية" للتوهج ويمكن أيضًا إظهاره في خيوط رفيعة تبرز من غشاء التوهج.
لقد تم مؤخرًا تأكيد وتوسيع فكرة انتقال مكونات الغلاف من داخل الخلية إلى السطح من خلال سلسلة من الدراسات باستخدام تجزئة الخلية وتحليل البروتينات الفيروسية في كسور مختلفة من الخلايا. تشير هذه الدراسات أيضًا إلى أن البروتين السكري HA، وربما بروتينات الغلاف الأخرى، يتم تصنيعه على الشبكة الإندوبلازمية الخشنة (Compans، 1973a؛ Klenk et al.، 1974). كما هو موضح في تجارب مطاردة النبض، بعد بضع دقائق تم العثور على HA في أغشية الشبكة الإندوبلازمية الملساء (كومبانز، 1973 أ؛ ستانلي وآخرون، 1973؛ كلينك وآخرون، 1974) وفي غشاء البلازما (ستانلي وآخرون، 1973). آل.، 1973). على الرغم من عدم إجراء تجارب المطاردة من الشبكة الإندوبلازمية الملساء إلى الغشاء البلازمي، يبدو من المعقول أن هاجر HA من الشبكة الإندوبلازمية الخشنة إلى غشاء البلازما، متجاوزًا الشبكة الإندوبلازمية الملساء. تجدر الإشارة إلى أنه خلال فترة هذه الهجرة بأكملها، تعد HA وبروتينات الغشاء الأخرى جزءًا لا يتجزأ من الأغشية التي تتحرك عبرها؛ لم يتم العثور على OBI أبدًا كبروتينات مذابة.
في أجزاء الغشاء الملساء، والتي يعتقد أنها مشتقة بشكل أساسي من الشبكة الإندوبلازمية، تم العثور على جميع بروتينات الغلاف الرئيسية (Compans 1973a; Klenk et al., 1974). ومع ذلك، تختلف كمياتها النسبية هنا عن تلك الموجودة في غشاء البلازما والفيريون (ستانلي وآخرون، 1973؛ كلينك وآخرون، 1974). تكون نسبة البروتين M إلى البروتين السكري HA أعلى في غلاف الفيريون الناضج عنها في أغشية الشبكة الإندوبلازمية. تشير هذه البيانات إلى أن كمية صغيرة فقط من الأغشية التي تحمل البروتين السكري HA يتم تحويلها إلى الغلاف الفيروسي، أي أجزاء الغشاء التي تحتوي على بروتينات خالية من الكربوهيدرات. كما سبقت الإشارة، قد يكون تخليق البروتين M هو المرحلة التي تحد من عملية تجميع الفيروس.
إن الاختلاف في معدل تخليق بروتينات الغلاف المختلفة يدعم الفرضية القائلة بأن تجميع الغلاف هو عملية متعددة المراحل، ويتوافق هذا المفهوم مع مسألة عملية تكوين HA*، بما في ذلك الإضافة المتتابعة لشق الكربوهيدرات و الانقسام البروتيني أثناء هجرة المنتج الجيني الأساسي.
ثامنا. إطلاق فيروس الأنفلونزا
مشكلة إطلاق فيروس الأنفلونزا من الخلية المضيفة،
يبدو أنها مرتبطة ارتباطًا وثيقًا بمشكلة الوظيفة الفيروسية
NA*، والتي سبق أن تمت مناقشتها بالتفصيل سابقًا (انظر
الحالات الخامس والفصل. 4). والحقيقة أن هذا الإنزيم يلعب دورا أساسيا
دور في إطلاق الفيروس، مستمد من القدرة المضادة
الهيئات الخاصة بـ NA * تمنع هذا الإطلاق (Se-
إلى روت، 1966؛ ويبستر وآخرون. G968). وعلاوة على ذلك، مثل هذه الأجسام المضادة
منع شطف الفيروس من كريات الدم الحمراء (براون، لافر،
1968). NA* البكتيرية، والتي لا يتم تثبيطها بواسطة الأجسام المضادة
لامي إلى NA* الفيروسي، قادر على إطلاق الفيروس من الخلايا،
تعامل مع مثل هذه الأجسام المضادة (كومبانز وآخرون، 1969؛
ويبستر، 1970). ومن ناحية أخرى، الأجسام المضادة ثنائية التكافؤ
إلى NA يسبب أيضًا تراكم الفيروسات (Seto and Chang، 1969؛
كومبانس وآخرون، 1969؛ ويبستر، 1970)، ومضاد أحادي التكافؤ
الأجسام لا تمنع إطلاق الفيروس، رغم أنها تمنعه
أكثر من 90% من نشاط النورامينيداز (Becht et al., 1971).
كل هذه البيانات مجتمعة تشير إلى ذلك
الأجسام المضادة ثنائية التكافؤ تتداخل مع إطلاق الفيروس
عن طريق ربطه بالمستضدات الموجودة على
سطح الخلية، وذلك عن طريق تثبيط نشاط الإنزيمات
شرطي. دور النورامينيداز في إطلاق فيروس العرض
أو باليس وآخرون. (G974) الذي أثبت أن هذا الفر
من الضروري إزالة حمض نيورواميليك من السادس
السطح الروسي لتجنب تجمعات الفيروسات - لاحقا -
كوف على سطح الخلية.
تاسعا. أشكال التكاثر غير الطبيعية
أ. الإنجاب المجهض اعتمادًا على الخلية المضيفة
يمكن لفيروسات الأنفلونزا أن تصيب مجموعة واسعة من الخلايا المضيفة. ومع ذلك، في العديد من الخلايا المصابة يكون إنتاج السلالة المعدية منخفضًا جدًا أو غير قابل للاكتشاف، على الرغم من أنه يمكن اكتشاف المكونات الفيروسية بعيارات طبيعية، ويسمى هذا النوع من انقطاع الدورة المعدية المعتمد على الخلية المضيفة بالعدوى المجهضة. لوحظت الدورة المعدية في الأصل في الفئران، المصابة في الدماغ بسلالات غير عصبية من فيروس الأنفلونزا (شليزنجر، 1953). كلما زادت الجرعة المعطاة من الفيروس، زادت كمية الهيماجلوتينين المُصنَّع حديثًا. العديد من الخلايا المضيفة الأخرى تم وصف أنظمة فيروسات الأنفلونزا A التي تم فيها إنتاج المستضد والراصة الدموية فقط RNP-^، ولكن ليس فيروسًا معديًا. في جميع أنظمة الأنف والأذن والحنجرة التي تمت دراستها حتى الآن، تراكم مستضد RNP في النواة ولم يتم اكتشافه
مسلحين بمساعدة الأجسام المضادة الفلورية في السيتوبلازم (Henle et al.، 1955؛ Franklin، Breitenfeld، 1959؛ Ter Meulen، Love، 1967؛ Fraser، 1967).
ب. ظاهرة فون ماغنوس
أثناء الممرات التسلسلية لفيروسات الأنفلونزا بتعددية أعلى من 1 (Barry, 1961)، تتشكل كميات متزايدة من الفيروسات غير المكتملة، الخارجة من الخلية المضيفة (von Magnus, 1951, 1952). هذه الجسيمات الفيروسية لها بنية سطحية متشابهة جدًا على سطح الخلية. بنية الفيروس المعدي، تكون مناعية: وتسبب تداخلًا متماثلًا. فهي تحتوي على كمية أقل من مستضد RNA وRNP، وتظهر نسبة أقل من العدوى إلى نشاط التراص الدموي وتحتوي على دهون أكثر من جزيئات الفيروس الكاملة (von Magnus, 1954; Isaacs, 1959; بوكر وآخرون، 1959؛ روت وشيفر، 1961؛ روت وشولتيسيك، 1963).
عند تحليل الحمض النووي الريبوزي (RNA) لفيروس جزئي، وجد أن الحمض النووي الريبي (RNA) الفيروسي ذو الوزن الجزيئي العالي نسبيًا إما غائب أو موجود بكميات منخفضة، بينما تزداد كمية الحمض النووي الريبي (RNA) ذو الوزن الجزيئي المنخفض (Duesberg, 1968; Pons, Hirst, 1969؛ ناياك، 1969).
في الخلايا المصابة بالمرور الثاني غير المخفف لفيروس الأنفلونزا، تكون جميع المعلومات الوراثية للفيروس موجودة، حيث أن cfRNA المعزول من هذه الخلايا قادر على تحويل، بعد التهجين، الحمض النووي الريبي المسمى المعزول من الفيروس المعدي إلى شكل RNA مقاوم للأزوت تمامًا (شولتيسيك، روت، 1969ب). وبالتالي، فإن الزيادة في كمية الحمض النووي الريبي (RNA) منخفض الوزن الجزيئي في الجزيئات غير المكتملة قد تكون بسبب ارتفاع الوزن الجزيئي للحمض النووي الريبي (RNA)، والذي يمكن تضمينه في هذه الجزيئات في شكل جزيئات مدمرة، وبالتالي غير عاملة. يتم دعم هذه الفكرة من خلال البيانات التي تفيد بأنه مع مرور غير مخفف بالعطش، تنخفض القدرة على إنتاج الفيروس المعدي أولاً، وبعد ذلك يتناقص تخليق الهيماجلوتينين والنورامينيداز، وأخيراً مستضد RNP (Scholtissek et al.، 1966).
وجد ناياك (1972) أنه خلال أول مرور عالي التعددية، كان الفيروس الذي ظهر مبكرًا معديًا تمامًا وأنتج نمطًا طبيعيًا من شظايا الحمض النووي الريبي للفيروس المعدي في تدرج السكروز، في حين أن الفيروس الذي ظهر لاحقًا كان له ملف تعريف RNA نموذجي غير مكتمل ( الخلفية) -Magnus)virus1.
- ديهدروتستوسترون عند الرجال - الوظيفة والقاعدة وعلم الأمراض
- الحصول على الأنسولين: جميع الطرق الرئيسية
- كيف تؤثر المنشطات على غدة البروستاتا. كيفية حماية البروستاتا أثناء الدورة
- ليس فيروسًا، وليس بروتينًا، ولكن اسمه بريون، البريون باختصار
- التغذية السليمة لقرحة المعدة
- تدليك الظهر العلاجي للجنف تدليك الظهر المتباين 10 15
- كيفية إزالة البلغم من الشعب الهوائية في المنزل
- نبات العنق السرطاني. متسلق الجبال الثعبان. جذر عنق السرطان
- ما هي فوائد الكمبوتشا؟
- ما هو الاستسقاء: الأنواع والعلاج
- بذور الكتان لعلاج الكلى
- كيف يعمل فيروس الأنفلونزا؟
- البروتين الزائد: ما مدى ضرره؟
- معايير التستوستيرون أثناء مراقبة المنشطات
- كيفية استخدام الأتروبين بشكل صحيح للعلاج المعقد عمل مزرعة الأتروبين
- ما هو قصور الغدد التناسلية عند الرجال وكيفية علاج هذا المرض
- يعتبر مفصل الرسغ الجهاز الحركي المثالي للطرف العلوي
- فوسفاتيديل كولين - حقن حرق الدهون
- متى يرتفع هرمون الديهدروتستوسترون عند النساء والرجال؟
- النظام الغذائي للتسمم الدرقي في الغدة الدرقية ما هي الأطعمة غير المسموح بها للتسمم الدرقي