இன்ஃப்ளூயன்ஸா வைரஸ் பிரதிபலிப்பு ஏற்படுகிறது. இன்ஃப்ளூயன்ஸா வைரஸ் எவ்வாறு செயல்படுகிறது? RTG ஐப் பயன்படுத்தி இன்ஃப்ளூயன்ஸா வைரஸ்களைக் கண்டறிதல்
அவை உள்செல்லுலார் கட்டாய ஒட்டுண்ணிகள், அதாவது உதவியின்றி அவற்றின் மரபணுக்களை நகலெடுக்கவோ அல்லது அனுப்பவோ முடியாது. ஒற்றை வைரஸ் துகள் (விரியன்) தானே செயலற்றது. ஒரு உயிரணுவை வைரஸ் தாக்கும் போது, அது என்சைம்கள் மற்றும் கலத்தின் கட்டமைப்பின் பெரும்பகுதியை நகலெடுக்க பயன்படுத்துகிறது.
மற்றும் போன்ற செல் பிரிவு செயல்முறைகளில் நாம் பார்ப்பது போலல்லாமல், வைரஸ் பிரதிபலிப்பு பல சந்ததிகளை உருவாக்குகிறது, அவை ஹோஸ்ட் செல்லை அழித்து பின்னர் உடலில் உள்ள மற்ற செல்களை பாதிக்கின்றன.
வைரஸ் மரபணு பொருள்
வைரஸ்கள் ஒற்றை இழை/இரட்டை இழை கொண்ட டிஎன்ஏ அல்லது ஆர்என்ஏவைக் கொண்டிருக்கலாம். ஒரு குறிப்பிட்ட வைரஸில் காணப்படும் மரபணுப் பொருட்களின் வகை அதன் இயல்பு மற்றும் செயல்பாட்டைப் பொறுத்தது. ஒரு புரவலன் பாதிக்கப்பட்ட பிறகு என்ன நடக்கிறது என்பதன் சரியான தன்மை வைரஸின் தன்மையைப் பொறுத்து மாறுபடும்.
டிஎஸ்டிஎன்ஏ, எஸ்எஸ்டிஎன்ஏ, டிஎஸ்ஆர்என்ஏ மற்றும் சிங்கிள்-ஸ்ட்ராண்ட் ஆர்என்ஏ வைரஸ்களுக்குப் பிரதி செயல்முறை வேறுபட்டதாக இருக்கும். எடுத்துக்காட்டாக, இரட்டை இழைகள் கொண்ட டிஎன்ஏ வைரஸ்கள் நகலெடுக்கும் முன் ஹோஸ்ட் செல்களுக்குள் நுழைய வேண்டும். இருப்பினும், ஒற்றை இழையுடைய RNA வைரஸ்கள் முதன்மையாக ஹோஸ்ட் செல்களில் பிரதிபலிக்கின்றன.
ஒரு வைரஸ் ஒரு புரவலரைப் பாதித்தவுடன், வைரஸ் சந்ததியினரின் கூறுகள் செல்லுலார் இயந்திரங்களால் உற்பத்தி செய்யப்படுகின்றன, மேலும் வைரஸ் கேப்சிட் ஒரு நொதி அல்லாத செயல்முறையாகும். வைரஸ்கள் பொதுவாக குறிப்பிட்ட எண்ணிக்கையிலான புரவலர்களை மட்டுமே பாதிக்கலாம். "பூட்டு மற்றும் விசை" பொறிமுறையானது இந்த நிகழ்வுக்கான பொதுவான விளக்கமாகும். வைரஸ் துகள்களில் உள்ள சில புரதங்கள் குறிப்பிட்ட ஹோஸ்டின் செல் மேற்பரப்பில் உள்ள சில ஏற்பி புரதங்களுடன் பொருந்த வேண்டும்.
வைரஸ்கள் செல்களை எவ்வாறு பாதிக்கின்றன?
நோய்த்தொற்றின் அடிப்படை செயல்முறை மற்றும் வைரஸின் பிரதிபலிப்பு 6 நிலைகளில் நிகழ்கிறது:
- உறிஞ்சுதல் - வைரஸ் புரவலன் கலத்துடன் பிணைக்கிறது.
- நுழைவு - வைரஸ் அதன் மரபணுவை புரவலன் கலத்தில் அறிமுகப்படுத்துகிறது.
- வைரஸ் மரபணு பிரதியீடு - வைரஸ் மரபணு ஹோஸ்டின் செல்லுலார் கட்டமைப்பைப் பயன்படுத்தி நகலெடுக்கப்படுகிறது.
- அசெம்பிளி - வைரஸ் கூறுகள் மற்றும் நொதிகள் உருவாகின்றன மற்றும் வரிசைப்படுத்தத் தொடங்குகின்றன.
- முதிர்வு - வைரஸ்கள் கூடியிருந்த கூறுகளிலிருந்து உருவாகின்றன.
- வெளியேறு - புதிய வைரஸ்கள் புதிய பாதிக்கப்பட்டவர்களைத் தேடி புரவலன் கலத்திலிருந்து வெளியேறுகின்றன.
வைரஸ்கள் உட்பட எந்த வகை உயிரணுவையும் பாதிக்கலாம்
ஆர்த்தோமைக்ஸோவைரஸின் குடும்பம் (கிரேக்க ஆர்த்தோஸ் - சரியானது, துகா - சளி) இன்ஃப்ளூயன்ஸா வைரஸ்கள் ஏ, பி, சி வகைகளை உள்ளடக்கியது, இது பாராமிக்சோவைரஸ்களைப் போலவே, மியூசினுடன் ஒரு உறவைக் கொண்டுள்ளது. இன்ஃப்ளூயன்ஸா A வைரஸ்கள் மனிதர்கள் மற்றும் சில வகையான விலங்குகள் (குதிரைகள், பன்றிகள், முதலியன) மற்றும் பறவைகளை பாதிக்கின்றன. இன்ஃப்ளூயன்ஸா வைரஸ்கள் வகை B மற்றும் C மனிதர்களுக்கு மட்டுமே நோய்க்கிருமிகள். முதல் மனித காய்ச்சல் வைரஸ் 1933 இல் W. ஸ்மித், சி. ஆண்ட்ரூஸ் மற்றும் P. லாடோ (WS ஸ்ட்ரெய்ன்) ஆகியோரால் வெள்ளை ஃபெர்ரெட்டுகளை பாதித்து மனிதர்களிடமிருந்து தனிமைப்படுத்தப்பட்டது. பின்னர், இந்த வைரஸ் வகை A என வகைப்படுத்தப்பட்டது. 1940 ஆம் ஆண்டில், T. பிரான்சிஸ் மற்றும் T. மெகில் ஆகியோர் இன்ஃப்ளூயன்ஸா வைரஸ் வகை B ஐக் கண்டுபிடித்தனர், மேலும் 1949 இல், R. டெய்லர் இன்ஃப்ளூயன்ஸா வைரஸ் வகை C ஐக் கண்டுபிடித்தனர். இன்ஃப்ளூயன்ஸா வைரஸ்களை வகைப்படுத்தும்போது, எப்போதும் இருந்தது அவற்றின் ஆன்டிஜெனிக் மாறுபாட்டுடன் தொடர்புடைய சில சிரமங்கள். இன்ஃப்ளூயன்ஸா வைரஸ்கள் A, B மற்றும் C என மூன்று வகைகளாகப் பிரிக்கப்படுகின்றன. வகை A ஆனது அவற்றின் ஆன்டிஜென்களில் ஒன்றுக்கொன்று வேறுபடும் பல துணை வகைகளை உள்ளடக்கியது - hemagglutinin மற்றும் neuraminidase. WHO வகைப்பாட்டின் படி (1980), மனித மற்றும் விலங்கு இன்ஃப்ளூயன்ஸா வைரஸ்கள் வகை A ஹெமாக்ளூட்டினின் (H1-H13) அடிப்படையில் 13 ஆன்டிஜெனிக் துணை வகைகளாகவும், நியூராமினிடேஸ் (N1-N10) அடிப்படையில் 10 வகைகளாகவும் பிரிக்கப்பட்டுள்ளன. இவற்றில், மனித இன்ஃப்ளூயன்ஸா வைரஸ்கள் வகை A இல் மூன்று ஹெமாக்ளூட்டினின்கள் (HI, H2 மற்றும் NZ) மற்றும் இரண்டு நியூராமினிடேஸ்கள் (N1 மற்றும் N2) ஆகியவை அடங்கும்.வகை A வைரஸுக்கு, hemagglutinin மற்றும் neuraminidase இன் துணை வகை அடைப்புக்குறிக்குள் குறிக்கப்படுகிறது. உதாரணமாக, இன்ஃப்ளூயன்ஸா A வைரஸ்: கபரோவ்ஸ்க்/90/77 (H1N1).அமைப்பு மற்றும் வேதியியல் கலவை
இன்ஃப்ளூயன்ஸா வைரஸ் 80-120 nm விட்டம் கொண்ட கோள வடிவத்தைக் கொண்டுள்ளது. நூல் போன்ற வடிவங்கள் குறைவாகவே காணப்படுகின்றன. ஹெலிகல் சமச்சீரின் நியூக்ளியோகேப்சிட் என்பது ஒரு ரைபோநியூக்ளியோபுரோட்டீன் (RNP) இழையாகும், இது ஒரு இரட்டை ஹெலிக்ஸில் அமைக்கப்பட்டிருக்கிறது, இது வைரியனின் மையத்தை உருவாக்குகிறது. RNA பாலிமரேஸ் மற்றும் எண்டோநியூக்லீஸ்கள் (P1 மற்றும் P3) அதனுடன் தொடர்புடையவை. மையமானது M புரதத்தை உள்ளடக்கிய ஒரு சவ்வு மூலம் சூழப்பட்டுள்ளது, இது RNP ஐ வெளிப்புற ஷெல்லின் லிப்பிட் பிளேயருடன் இணைக்கிறது மற்றும் ஸ்டைலாய்டு செயல்முறைகள் ஹேமக்ளூட்டினின் மற்றும் நியூராமினிடேஸ் ஆகியவற்றைக் கொண்டுள்ளது.விரியன்கள் சுமார் 1% RNA, 70% புரதம், 24% லிப்பிடுகள் மற்றும் 5 ஆகியவற்றைக் கொண்டிருக்கின்றன. % கார்போஹைட்ரேட். லிப்பிடுகள் மற்றும் கார்போஹைட்ரேட்டுகள் லிப்போபுரோட்டின்கள் மற்றும் வெளிப்புற ஷெல்லின் கிளைகோபுரோட்டின்களின் பகுதியாகும் மற்றும் அவை செல்லுலார் தோற்றம் கொண்டவை. வைரஸின் மரபணு ஒரு மைனஸ்-ஸ்ட்ராண்ட் துண்டு துண்டான RNA மூலக்கூறால் குறிப்பிடப்படுகிறது. இன்ஃப்ளூயன்ஸா வைரஸ்கள் A மற்றும் B வகைகளில் 8 RNA துண்டுகள் உள்ளன. இவற்றில் 5 ஒரு புரதத்தை குறியாக்குகின்றன, கடைசி 3 இரண்டு புரதங்களை குறியாக்கம் செய்கின்றன.ஆன்டிஜென்கள்
இன்ஃப்ளூயன்ஸா வைரஸ்கள் A, B மற்றும் C ஆகியவை RNP (NP புரதம்) மற்றும் M-மேட்ரிக்ஸ் புரதத்துடன் தொடர்புடைய வகை-குறிப்பிட்ட ஆன்டிஜென் ஆகியவற்றில் ஒருவருக்கொருவர் வேறுபடுகின்றன, இது விரியன் கட்டமைப்பை உறுதிப்படுத்துகிறது.இந்த ஆன்டிஜென்கள் RSC இல் கண்டறியப்படுகின்றன. வகை A வைரஸின் குறுகிய தனித்தன்மையானது மற்ற இரண்டு மேற்பரப்பு ஆன்டிஜென்களால் தீர்மானிக்கப்படுகிறது - ஹீமாக்ளூட்டினின் H மற்றும் நியூராமினிடேஸ் N, வரிசை எண்களால் குறிக்கப்படுகிறது.ஹேமக்ளூட்டினின் என்பது பாதுகாப்பு பண்புகளைக் கொண்ட ஒரு சிக்கலான கிளைகோபுரோட்டீன் ஆகும். இது உடலில் வைரஸ்-நடுநிலைப்படுத்தும் ஆன்டிபாடிகளின் உருவாக்கத்தை தூண்டுகிறது - RTGA இல் கண்டறியப்பட்ட ஆன்டிஹெமாக்ளூட்டினின்கள். ஹெமாக்ளூட்டினின் (எச்-ஆன்டிஜென்) மாறுபாடு, இன்ஃப்ளூயன்ஸா வைரஸின் ஆன்டிஜெனிக் சறுக்கல் மற்றும் மாற்றத்தை தீர்மானிக்கிறது. ஆன்டிஜெனிக் சறுக்கல் என்பது அதன் உருவாக்கத்தைக் கட்டுப்படுத்தும் மரபணுவில் உள்ள புள்ளி பிறழ்வுகளால் H-ஆன்டிஜெனில் ஏற்படும் சிறிய மாற்றங்களைக் குறிக்கிறது. ஆன்டிபாடிகள் போன்ற தேர்ந்தெடுக்கப்பட்ட காரணிகளின் செல்வாக்கின் கீழ் இத்தகைய மாற்றங்கள் சந்ததிகளில் குவிந்துவிடும். இது இறுதியில் ஒரு அளவு மாற்றத்திற்கு வழிவகுக்கிறது, இது ஹெமாக்ளூட்டினின் ஆன்டிஜெனிக் பண்புகளில் ஏற்படும் மாற்றத்தில் வெளிப்படுத்தப்படுகிறது. ஆன்டிஜெனிக் மாற்றத்துடன், மரபணுவின் முழுமையான மாற்றீடு ஏற்படுகிறது, இது இரண்டு வைரஸ்களுக்கு இடையில் மீண்டும் இணைவதை அடிப்படையாகக் கொண்டது. இது ஹெமாக்ளூட்டினின் அல்லது நியூராமினிடேஸின் துணை வகையிலும், சில சமயங்களில் ஆன்டிஜென்கள் இரண்டிலும் மாற்றம் ஏற்படுகிறது, மேலும் வைரஸின் அடிப்படையில் புதிய ஆன்டிஜெனிக் மாறுபாடுகள் தோன்றி, பெரிய தொற்றுநோய்கள் மற்றும் தொற்றுநோய்களை ஏற்படுத்துகிறது.ஹேமக்ளூட்டினின் ஒரு ஏற்பியாகும், இதன் மூலம் உணர்திறன் உயிரணுக்களில் வைரஸ் உறிஞ்சப்படுகிறது. , எரித்ரோசைட்டுகள் உட்பட, அவை ஒன்றாக ஒட்டிக்கொண்டிருக்கும் , மற்றும் இரத்த சிவப்பணுக்களின் ஹீமோலிசிஸில் ஈடுபட்டுள்ளது வைரல் நியூராமினிடேஸ் என்பது அடி மூலக்கூறில் இருந்து சியாலிக் அமிலத்தின் பிளவுகளை ஊக்குவிக்கும் ஒரு நொதியாகும். இது ஆன்டிஜெனிக் பண்புகளைக் கொண்டுள்ளது மற்றும் அதே நேரத்தில் புரவலன் கலத்திலிருந்து விரியன்களை வெளியிடுவதில் பங்கேற்கிறது. நியூராமினிடேஸ், ஹெமாக்ளூட்டினின் போன்றது, ஆன்டிஜெனிக் சறுக்கல் மற்றும் மாற்றத்தின் விளைவாக மாறுகிறது.சாகுபடி மற்றும் இனப்பெருக்கம்
இன்ஃப்ளூயன்ஸா வைரஸ்கள் கோழி கருக்கள் மற்றும் செல் கலாச்சாரங்களில் வளர்க்கப்படுகின்றன. உகந்த சூழல் கோழி கருக்கள், அம்னோடிக் மற்றும் அலன்டோயிக் குழிகளில் வைரஸ் 36-48 மணி நேரத்திற்குள் இனப்பெருக்கம் செய்கிறது, இன்ஃப்ளூயன்ஸா வைரஸுக்கு மிகவும் உணர்திறன் வாய்ந்தது மனித கரு சிறுநீரக செல்கள் மற்றும் சில விலங்குகளின் முதன்மை கலாச்சாரங்கள். இந்த கலாச்சாரங்களில் வைரஸின் இனப்பெருக்கம் ஒரு லேசான CPE உடன் சேர்ந்து, தன்னிச்சையான செல் சிதைவை நினைவூட்டுகிறது. இன்ஃப்ளூயன்ஸா வைரஸ்கள் எபிடெலியல் செல்களின் கிளைகோபுரோட்டீன் ஏற்பிகளில் உறிஞ்சப்படுகின்றன, அவை ஏற்பி எண்டோசைட்டோசிஸ் மூலம் ஊடுருவுகின்றன. வைரஸ் மரபணுவின் படியெடுத்தல் மற்றும் பிரதியெடுப்பு செல் கருவில் நிகழ்கிறது. இந்த வழக்கில், m-RNA வடிவத்தில் வாசிக்கப்பட்ட தனிப்பட்ட RNA துண்டுகள் ரைபோசோம்களாக மொழிபெயர்க்கப்படுகின்றன, அங்கு வைரஸ்-குறிப்பிட்ட புரதங்களின் தொகுப்பு ஏற்படுகிறது. வைரஸ் மரபணுவின் நகலெடுத்த பிறகு, வைரஸ் ஆர்என்ஏக்களின் ஒரு குளம் உருவாகிறது, இது புதிய நியூக்ளியோகாப்சிட்களின் தொகுப்பில் பயன்படுத்தப்படுகிறது.நோய்க்கிருமி உருவாக்கம்
வைரஸின் முதன்மை இனப்பெருக்கம் சுவாசக் குழாயின் எபிடெலியல் செல்களில் நிகழ்கிறது. சளி சவ்வு அரிக்கப்பட்ட மேற்பரப்பு வழியாக, வைரஸ் இரத்தத்தில் நுழைகிறது, இதனால் வைரேமியா ஏற்படுகிறது. இரத்தத்தில் உள்ள வைரஸின் சுழற்சி இரத்த நுண்குழாய்களின் எண்டோடெலியல் செல்களுக்கு சேதம் ஏற்படுகிறது, இதன் விளைவாக அவற்றின் ஊடுருவல் அதிகரிக்கிறது. கடுமையான சந்தர்ப்பங்களில், நுரையீரல், இதய தசை மற்றும் பிற உள் உறுப்புகளில் இரத்தக்கசிவு காணப்படுகிறது. இன்ஃப்ளூயன்ஸா வைரஸ்கள், நிணநீர் முனைகளில் நுழைந்து, லிம்போசைட்டுகளை சேதப்படுத்துகின்றன, இதன் விளைவாக நோயெதிர்ப்பு குறைபாடு ஏற்படுகிறது, இது இரண்டாம் நிலை பாக்டீரியா தொற்று ஏற்படுவதற்கு பங்களிக்கிறது.நோய் எதிர்ப்பு சக்தி
இன்ஃப்ளூயன்ஸா எதிர்ப்பு நோய் எதிர்ப்பு சக்தியின் பொறிமுறையானது ஆன்டிவைரல் அல்லாத பாதுகாப்பின் இயற்கையான காரணிகளுடன் தொடர்புடையது, முக்கியமாக இண்டர்ஃபெரான் மற்றும் இயற்கை கொலையாளி உயிரணுக்களின் உற்பத்தி, செல்லுலார் மற்றும் நகைச்சுவை எதிர்வினை காரணிகளால் குறிப்பிட்ட நோய் எதிர்ப்பு சக்தி வழங்கப்படுகிறது. முதலாவது மேக்ரோபேஜ்கள் மற்றும் டி-கில்லர்களால் குறிப்பிடப்படுகின்றன. இரண்டாவது இம்யூனோகுளோபுலின்கள், முதன்மையாக ஆன்டிஹெமாக்ளூட்டின்கள் மற்றும் ஆன்டிநியூரோமினிடேஸ் ஆன்டிபாடிகள், இவை வைரஸ்-நடுநிலைப்படுத்தும் பண்புகளைக் கொண்டுள்ளன. பிந்தையது, antihemagglutinins போலல்லாமல், இன்ஃப்ளூயன்ஸா வைரஸை ஓரளவு மட்டுமே நடுநிலையாக்குகிறது, அதன் பரவலைத் தடுக்கிறது. வைரஸ் நியூக்ளியோபுரோட்டீனுக்கு நிரப்பு-சரிசெய்யும் ஆன்டிபாடிகள் 1.5 மாதங்களுக்குப் பிறகும் பாதுகாப்பு பண்புகளைக் கொண்டிருக்கவில்லை. நோய் தொடங்கிய 3-4 நாட்களுக்குப் பிறகு இரத்த சீரத்தில் ஆன்டிபாடிகள் கண்டறியப்பட்டு 2-3 வாரங்களுக்குப் பிறகு அதிகபட்ச டைட்டர்களை அடைகின்றன. இன்ஃப்ளூயன்ஸா தொற்றுக்குப் பிறகு பெறப்பட்ட குறிப்பிட்ட நோய் எதிர்ப்பு சக்தியின் காலம், முந்தைய நம்பிக்கைகளுக்கு மாறாக, பல தசாப்தங்களில் அளவிடப்படுகிறது. 1977 ஆம் ஆண்டு A (H1N1) வைரஸால் ஏற்படும் இன்ஃப்ளூயன்ஸாவின் வயது அமைப்பு பற்றிய ஆய்வின் அடிப்படையில் இந்த முடிவு எட்டப்பட்டது. 1957 ஆம் ஆண்டு முதல் இல்லாத இந்த வைரஸ் 20 வயதுக்குட்பட்டவர்களை மட்டுமே பாதித்தது கண்டறியப்பட்டது. 1977 ஆம் ஆண்டில், இன்ஃப்ளூயன்ஸா வைரஸ் வகை A யால் ஏற்பட்ட இன்ஃப்ளூயன்ஸா தொற்றுக்கு ஆளான பிறகு, தீவிரமான நோய் எதிர்ப்பு சக்தி உருவாகிறது, அது உருவாவதற்கு காரணமான வைரஸின் துணை வகைக்கு (H- மற்றும் N- ஆன்டிஜென்களால்) கண்டிப்பாக குறிப்பிட்டது. கூடுதலாக, புதிதாகப் பிறந்த குழந்தைகளுக்கு IgG ஆன்டிபாடிகள் காரணமாக செயலற்ற நோய் எதிர்ப்பு சக்தி தொடர்புடைய வைரஸ் துணை வகை A. நோய் எதிர்ப்பு சக்தி 6-8 மாதங்கள் வரை நீடிக்கும்.தொற்றுநோயியல்
நோய்த்தொற்றின் ஆதாரம் நோயுற்றவர்கள் மற்றும் வைரஸ் கேரியர்கள். நோய்க்கிருமியின் பரவுதல் வான்வழி நீர்த்துளிகள் மூலம் ஏற்படுகிறது. இன்ஃப்ளூயன்ஸா என்பது ஒரு தொற்றுநோயாகும், இது குளிர்காலம் மற்றும் குளிர்கால-வசந்த மாதங்களில் அடிக்கடி நிகழ்கிறது. ஏறக்குறைய ஒவ்வொரு பத்து வருடங்களுக்கும், இன்ஃப்ளூயன்ஸா தொற்றுநோய்கள் தொற்றுநோயாக மாறி, வெவ்வேறு கண்டங்களின் மக்களை பாதிக்கிறது. ஆன்டிஜெனிக் டிரிஃப்ட் மற்றும் ஷிஃப்டுடன் தொடர்புடைய வகை A வைரஸின் H- மற்றும் N- ஆன்டிஜென்களின் மாற்றத்தால் இது விளக்கப்படுகிறது. எடுத்துக்காட்டாக, ஹெமாக்ளூட்டினின் NSW1 உடன் கூடிய இன்ஃப்ளூயன்ஸா A வைரஸ் 1918 இல் ஸ்பானிஷ் காய்ச்சல் தொற்றுநோயை ஏற்படுத்தியது, இது 20 மில்லியன் மனித உயிர்களைக் கொன்றது. 1957 ஆம் ஆண்டில், "ஆசிய" இன்ஃப்ளூயன்ஸா வைரஸ் (H2N2) 2 பில்லியனுக்கும் அதிகமான மக்களைப் பாதித்த ஒரு தொற்றுநோயை ஏற்படுத்தியது. 1968 ஆம் ஆண்டில், ஒரு புதிய தொற்றுநோய் மாறுபாடு தோன்றியது, இன்ஃப்ளூயன்ஸா A (H3N2) வைரஸ், ஹாங்காங் வைரஸ் என்று அழைக்கப்படுகிறது, இது இன்றுவரை தொடர்ந்து பரவி வருகிறது. 1977 ஆம் ஆண்டில், இது வகை A வைரஸால் (H1N1) இணைந்தது, இது எதிர்பாராதது, ஏனெனில் 1947-1957 ஆம் ஆண்டில் ஒரே மாதிரியான வைரஸ் ஏற்கனவே பரவியிருந்தது, பின்னர் "ஆசிய" துணை வகையால் முழுமையாக மாற்றப்பட்டது. இது சம்பந்தமாக, வைரஸின் ஷிப்ட் மாறுபாடுகள் வரலாற்று ரீதியாக புதியவை அல்ல என்று ஒரு கருதுகோள் எழுந்தது. அவை கடந்த ஆண்டுகளில் புழக்கத்தில் உள்ள செரோசப்டைப்களைக் குறிக்கின்றன.அடுத்த தொற்றுநோயை ஏற்படுத்திய இன்ஃப்ளூயன்ஸா வைரஸின் சுழற்சியை நிறுத்துவது, நோய்க்கிருமியின் இந்த ஆன்டிஜெனிக் மாறுபாட்டிற்கு வளர்ந்த மக்கள்தொகையின் கூட்டு நோய் எதிர்ப்பு சக்தியால் விளக்கப்படுகிறது. இந்த பின்னணியில், புதிய ஆன்டிஜெனிக் மாறுபாடுகளின் தேர்வு உள்ளது, கூட்டு நோய் எதிர்ப்பு சக்தி இன்னும் உருவாகவில்லை, இன்ஃப்ளூயன்ஸா ஏ வைரஸின் ஷிப்ட் ஆன்டிஜெனிக் மாறுபாடுகள் (செரோசப்டைப்ஸ்) எங்கு செயலில் புழக்கத்தில் இருந்து வெளியேறியது என்பது இன்னும் தெளிவாகத் தெரியவில்லை. மற்றொரு வரலாற்று காலம் நீண்ட காலமாக பாதுகாக்கப்படுகிறது. இத்தகைய வைரஸ்கள் தொடர்ந்து நிலைத்திருப்பதற்கான நீர்த்தேக்கம் காட்டு மற்றும் வீட்டு விலங்குகள், குறிப்பாக பறவைகள், அவை வகை A இன்ஃப்ளூயன்ஸா வைரஸ்களின் மனித மாறுபாடுகளால் பாதிக்கப்பட்டு நீண்ட காலத்திற்கு அவற்றின் சுழற்சியை பராமரிக்கின்றன. அதே நேரத்தில், பறவைகள் மற்றும் மனித வைரஸ்களுக்கு இடையிலான மரபணு மறுசீரமைப்புகள் பறவைகளின் உடலில் நிகழ்கின்றன, இது புதிய ஆன்டிஜெனிக் மாறுபாடுகளை உருவாக்க வழிவகுக்கிறது.மற்றொரு கருதுகோளின் படி, அறியப்பட்ட அனைத்து துணை வகைகளின் இன்ஃப்ளூயன்ஸா வைரஸ்கள் தொடர்ந்து மக்களிடையே பரவுகின்றன, ஆனால் அவை தொற்றுநோய்க்கு பொருத்தமானவை. கூட்டு நோய் எதிர்ப்பு சக்தி குறைவதால் மட்டுமே இன்ஃப்ளூயன்ஸா வைரஸ்கள் B மற்றும் C வகைகளின் அதிக ஆன்டிஜெனிக் நிலைத்தன்மையால் வகைப்படுத்தப்படுகின்றன. இன்ஃப்ளூயன்ஸா பி வைரஸ்கள் குறைவான தீவிரமான தொற்றுநோய்கள் மற்றும் உள்ளூர் வெடிப்புகளை ஏற்படுத்துகின்றன. இன்ஃப்ளூயன்ஸா வைரஸ் வகை C ஆங்காங்கே நோய்களுக்குக் காரணமாகும்.56°C க்கும் அதிகமான வெப்பநிலை, UV கதிர்வீச்சு, கிருமிநாசினிகள் மற்றும் சவர்க்காரம் ஆகியவற்றால் காய்ச்சல் வைரஸ் விரைவாக அழிக்கப்படுகிறது. இது 1 நாளுக்கு சாத்தியமானதாக இருக்கும். அறை வெப்பநிலையில், மென்மையான உலோகம் மற்றும் பிளாஸ்டிக் பரப்புகளில் - 2 நாட்கள் வரை. இன்ஃப்ளூயன்ஸா வைரஸ்கள் குறைந்த வெப்பநிலையில் (-70°C) உயிர்வாழ்கின்றன.குறிப்பிட்ட தடுப்பு
இன்ஃப்ளூயன்ஸாவைத் தடுக்க, ரிமண்டடைன் பயன்படுத்தப்படுகிறது, இது இன்ஃப்ளூயன்ஸா வைரஸ் வகை A இன் இனப்பெருக்கத்தை அடக்குகிறது. செயலற்ற தடுப்புக்கு, இன்ஃப்ளூயன்ஸா தடுப்பூசி மூலம் தடுப்பூசி போடப்பட்ட நன்கொடையாளர்களின் இரத்த சீரம் மூலம் பெறப்பட்ட மனித காய்ச்சல் எதிர்ப்பு இம்யூனோகுளோபுலின் பயன்படுத்தப்படுகிறது. மனித லிகோசைட் இண்டர்ஃபெரான் ஒரு குறிப்பிட்ட விளைவைக் கொண்டிருக்கிறது, தடுப்பூசி தடுப்புக்கு நேரடி மற்றும் செயலிழக்கச் செய்யப்பட்ட தடுப்பூசிகள் பயன்படுத்தப்படுகின்றன. நேரடி தடுப்பூசிகள் நிர்வகிக்கப்படும் போது, பொது மற்றும் உள்ளூர் நோய் எதிர்ப்பு சக்தி உருவாகிறது. கூடுதலாக, இன்டர்ஃபெரான் தூண்டல் குறிப்பிடப்பட்டுள்ளது.தற்போது, பல்வேறு வகையான செயலிழந்த தடுப்பூசிகள் பெறப்பட்டுள்ளன: விரியன், சப்யூனிட், பிளவு மற்றும் கலப்பு. கோழிக் கருவில் வளர்க்கப்படும் வைரஸ்களை உயர்தர சுத்திகரிப்பு மூலம் விரியன் தடுப்பூசிகள் தயாரிக்கப்படுகின்றன. சப்யூனிட் தடுப்பூசிகள் இன்ஃப்ளூயன்ஸா வைரஸின் சுத்திகரிக்கப்பட்ட மேற்பரப்பு ஆன்டிஜென்கள் - ஹெமாக்ளூட்டினின்கள் மற்றும் நியூராமினிடேஸ். இத்தகைய தடுப்பூசி தயாரிப்புகள் குறைக்கப்பட்ட எதிர்வினை மற்றும் அதிக நோயெதிர்ப்பு சக்தியால் வகைப்படுத்தப்படுகின்றன. பிளவுபட்ட அல்லது சிதைந்த தடுப்பூசிகள், சவர்க்காரங்களுடன் சிகிச்சையளிப்பதன் மூலம் சுத்திகரிக்கப்பட்ட விரியன் இடைநீக்கத்திலிருந்து தயாரிக்கப்படுகின்றன. இருப்பினும், இந்த தடுப்பூசிகளில் ஏதேனும் ஒன்றின் மேன்மை குறித்து இன்னும் ஒருமித்த கருத்து இல்லை. செயலிழந்த தடுப்பூசிகள் பொது மற்றும் உள்ளூர் நகைச்சுவை நோய் எதிர்ப்பு சக்தி அமைப்பில் நோயெதிர்ப்பு மறுமொழியைத் தூண்டுகின்றன, ஆனால் நேரடி தடுப்பூசிகளுடன் ஒப்பிடும்போது குறைந்த அளவிற்கு இண்டர்ஃபெரான் தொகுப்பைத் தூண்டுகின்றன.நேரடி மற்றும் செயலிழந்த தடுப்பூசிகளைப் பயன்படுத்துவதில் பல வருட அனுபவம், தடுப்பூசி விகாரங்களின் ஆன்டிஜெனிக் பொருந்தாத தன்மையைக் குறிக்கிறது. தொற்றுநோய்கள் முதன்மையானது, ஆனால் காய்ச்சல் தடுப்பூசி தடுப்புக்கான குறைந்த செயல்திறன் மட்டுமே காரணம் அல்ல. சமீபத்திய ஆண்டுகளில், மரபணு ரீதியாக வடிவமைக்கப்பட்ட மற்றும் செயற்கை காய்ச்சல் தடுப்பூசிகளை உருவாக்க முயற்சிகள் மேற்கொள்ளப்பட்டுள்ளன.காய்ச்சல்
இன்ஃப்ளூயன்ஸா என்பது ஒரு கடுமையான மனித சுவாச நோயாகும், இது தொற்றுநோயாக பரவுகிறது. இது மேல் சுவாசக் குழாயின் கண்புரை அழற்சி, காய்ச்சல் மற்றும் கடுமையான பொது போதை ஆகியவற்றால் வகைப்படுத்தப்படுகிறது. இன்ஃப்ளூயன்ஸா அடிக்கடி கடுமையான சிக்கல்களுடன் சேர்ந்துள்ளது - இரண்டாம் நிலை பாக்டீரியா நிமோனியா, நாள்பட்ட நுரையீரல் நோய்களின் தீவிரமடைதல். இது மூன்று வகையான வைரஸ்களை உள்ளடக்கியது - A, B, C. இன்ஃப்ளூயன்ஸா வைரஸ் ஒரு கோள வடிவத்தைக் கொண்டுள்ளது, அதன் அளவு 80-120 nm ஆகும். சில நேரங்களில் இழைகள் கொண்ட விரியன்கள் உருவாகின்றன. ஜீனோம் ஒரு ஒற்றை இழையுடைய மைனஸ்-ஸ்ட்ராண்ட் ஆர்என்ஏ மூலம் உருவாகிறது, இதில் எட்டு துண்டுகள் உள்ளன, மேலும் இது ஒரு புரத கேப்சிடால் சூழப்பட்டுள்ளது. RNA 4 உள் புரதங்களுடன் தொடர்புடையது: நியூக்ளியோபுரோட்டின்கள் (NP) மற்றும் உயர் மூலக்கூறு எடை புரதங்கள் PI, P2, R3, மரபணு படியெடுத்தல் மற்றும் வைரஸ் பிரதியெடுப்பில் ஈடுபட்டுள்ளது. நியூக்ளியோகாப்சிட் ஒரு ஹெலிகல் வகை சமச்சீர் தன்மையைக் கொண்டுள்ளது. கேப்சிட் ஷெல்லின் மேல் மேட்ரிக்ஸ் புரதத்தின் (எம் புரதம்) ஒரு அடுக்கு உள்ளது. வெளிப்புறத்தில், சூப்பர் கேப்சிட் ஷெல், ஹெமாக்ளூட்டினின் (எச்) மற்றும் நியூராமினிடேஸ் (என்) ஆகியவை முதுகெலும்புகளின் வடிவத்தில் அமைந்துள்ளன. இரண்டு கிளைகோபுரோட்டீன்களும் (N மற்றும் H) ஆன்டிஜெனிக் பண்புகளை உச்சரிக்கின்றன. இன்ஃப்ளூயன்ஸா வைரஸ்களில், 13 வெவ்வேறு ஆன்டிஜெனிக் வகையான ஹெமாக்ளூட்டினின் (NI-13) மற்றும் நியூராமினிடேஸின் 10 வகைகள் (N1-10) கண்டறியப்பட்டன. உட்புற நியூக்ளியோபுரோட்டீன் ஆன்டிஜெனின் அடிப்படையில், மூன்று வகையான இன்ஃப்ளூயன்ஸா வைரஸ்கள் வேறுபடுகின்றன - ஏ, பி, சி. RSC இல் தீர்மானிக்க முடியும். மனிதர்களைப் பாதிக்கும் வகை A வைரஸ்களில் மூன்று வகையான ஹெமாக்ளூட்டினின் (HI, H2, H3) மற்றும் இரண்டு நியூராமினிடேஸ்கள் (N1, N2) உள்ளன. அவற்றின் சேர்க்கைகளைப் பொறுத்து, இன்ஃப்ளூயன்ஸா A வைரஸ்களின் மாறுபாடுகள் வேறுபடுகின்றன - H1N1, H2N2, H3N2. அவை பொருத்தமான செராவுடன் ஹீமாக்ளூட்டினேஷன் தடுப்பு வினையில் தீர்மானிக்கப்படுகின்றன.இன்ஃப்ளூயன்ஸா வைரஸ்கள் கோழி கருக்கள் மற்றும் பல்வேறு செல் கலாச்சாரங்களில் எளிதாக வளர்க்கப்படுகின்றன. வைரஸ்களின் அதிகபட்ச குவிப்பு 2-3 நாட்களுக்குப் பிறகு ஏற்படுகிறது. வெளிப்புற சூழலில், வைரஸ் உலர்த்துவதன் மூலம் அதன் தொற்றுநோயை விரைவாக இழக்கிறது. குளிர்சாதன பெட்டியில் குறைந்த வெப்பநிலையில் அது ஒரு வாரம் சேமிக்கப்படும், -70 ° C - மிக நீண்ட. சூடாக்குவது சில நிமிடங்களுக்குப் பிறகு செயலிழக்கச் செய்கிறது. ஈதர், பீனால், ஃபார்மால்டிஹைடு ஆகியவற்றின் செல்வாக்கின் கீழ், அது விரைவாக அழிக்கப்படுகிறது.வைராலஜிக்கல் கண்டறியும் முறை
ஆராய்ச்சிக்கான பொருள் நாசோபார்னெக்ஸில் இருந்து துடைப்பம், நாசி வெளியேற்றம், இது நோய், ஸ்பூட்டம் ஆகியவற்றின் முதல் நாட்களில் உலர்ந்த அல்லது ஈரமான மலட்டு பருத்தி துணியால் எடுக்கப்படுகிறது. இரத்தம் மற்றும் செரிப்ரோஸ்பைனல் திரவத்தில் வைரஸ்கள் காணப்படுகின்றன. மரணம் ஏற்பட்டால், மேல் மற்றும் கீழ் சுவாசக்குழாய், மூளை போன்றவற்றின் பாதிக்கப்பட்ட திசுக்களின் துண்டுகள் அகற்றப்படுகின்றன.நாசோபார்னீஜியல் ஸ்வாப்கள் வெறும் வயிற்றில் எடுக்கப்படுகின்றன. நோயாளி ஒரு மலட்டு அகல கழுத்து ஜாடியில் சேகரிக்கப்பட்ட மலட்டு உப்பு சோடியம் குளோரைடு கரைசலை (10-15 மில்லி) கொண்டு மூன்று முறை வாய் கொப்பளிக்க வேண்டும். இதற்குப் பிறகு, குரல்வளை மற்றும் நாசிப் பாதைகளின் பின்புற சுவரை ஒரு மலட்டு பருத்தி கம்பளியால் துடைத்து, பின்னர் அதை ஒரு ஜாடியில் நனைத்து, சோடியம் குளோரைடு கரைசலில் ஈரப்படுத்தப்பட்ட ஒரு மலட்டு துணியால் பொருளை எடுக்கலாம். தொண்டையின் பின்புற சுவரை நன்கு துடைக்கவும். பொருளைச் சேகரித்த பிறகு, துடைப்பம் உடலியல் தீர்வுடன் ஒரு சோதனைக் குழாயில் மூழ்கியுள்ளது, இதில் 5% செயலிழந்த விலங்கு சீரம் சேர்க்கப்படுகிறது. ஆய்வகத்தில், ஸ்வாப்கள் திரவத்தில் துவைக்கப்படுகின்றன, குழாயின் பக்கத்திற்கு எதிராக அழுத்தி, அகற்றப்படுகின்றன. வடிகால் குடியேற குளிர்சாதன பெட்டியில் வைக்கப்படுகிறது, பின்னர் திரவத்தின் நடுத்தர பகுதி மலட்டு குழாய்களில் சேகரிக்கப்படுகிறது. நுண்ணுயிர் எதிர்ப்பிகள் பென்சிலின் (200-1000 IU/ml), ஸ்ட்ரெப்டோமைசின் (200-500 μg/ml), நிஸ்டாடின் (100-1000 IU/ml) ஆகியவை அதனுடன் இருக்கும் மைக்ரோஃப்ளோராவை அழிக்கும் பொருட்களில் சேர்க்கப்படுகின்றன, அவை அறை வெப்பநிலையில் 30 நிமிடங்கள் வைக்கப்பட்டு பயன்படுத்தப்படுகின்றன. வைரஸ்களைத் தனிமைப்படுத்துதல். மலட்டுத்தன்மைக்காக முன்பு அதைச் சோதித்த பிறகு. 10-11 நாள் பழமையான கோழிக் கருவைத் தாக்கும் வைரஸ்களைத் தனிமைப்படுத்துவதற்கான ஒரு உணர்திறன் முறை. 0.1-0.2 மில்லி அளவுள்ள பொருள் அம்னோடிக் அல்லது அலன்டோயிஸ் குழிக்குள் செலுத்தப்படுகிறது. ஒரு விதியாக, 3-5 கருக்கள் பாதிக்கப்பட்டுள்ளன. கருக்கள் 72 மணி நேரம் 33-34 ° C உகந்த வெப்பநிலையில் அடைகாக்கப்படுகின்றன. சோதனைப் பொருளில் உள்ள விரியன்களின் எண்ணிக்கையை அதிகரிப்பதற்காக, அது முன்-செறிவூட்டப்படுகிறது. இதைச் செய்ய, கோழியின் இரத்த சிவப்பணுக்களில் வைரஸ்களை உறிஞ்சும் முறைகள், வைரஸ்களின் தொற்று பண்புகளை அதிகரிக்க 0.2% டிரிப்சின் கரைசலுடன் சிகிச்சை அல்லது சிறப்பு முறைகளைப் பயன்படுத்தி அவற்றைத் துரிதப்படுத்துதல் ஆகியவற்றைப் பயன்படுத்துகின்றனர். 2-4 மணிநேரத்திற்கு 4 ° C வெப்பநிலை, பின்னர் குழாய்கள் அல்லது ஒரு சிரிஞ்ச், அலன்டோயிக் அல்லது அம்னோடிக் திரவத்துடன் மலட்டுத்தன்மையுடன் உறிஞ்சப்படுகிறது. இந்த வழக்கில், ஒரு தொற்று வைரஸ் இருப்பது RGA ஐப் பயன்படுத்தி தீர்மானிக்கப்படுகிறது. இதை செய்ய, சம அளவுகள் (0.2 மில்லி) வைரஸ் எதிர்ப்பு பொருள் மற்றும் கோழி சிவப்பு இரத்த அணுக்களின் 1% இடைநீக்கம் ஆகியவற்றை கலக்கவும். ஒரு நேர்மறை எதிர்வினை (பொருளில் வைரஸ் இருப்பது) குடை வடிவில் எரித்ரோசைட்டுகளின் வண்டல் மூலம் குறிக்கப்படுகிறது.ஹெமாக்ளூட்டினஸ் பண்புகளைக் கொண்ட பொருளில் வைரஸ் இருந்தால், அது விரிவாக்கப்பட்ட RGA ஐப் பயன்படுத்தி டைட்ரேட் செய்யப்படுகிறது, ஹீமாக்ளூட்டினஸ் செயல்பாட்டின் தலைப்பு. இந்த எதிர்வினையைப் பயன்படுத்தி, ஹீமாக்ளூட்டினேட்டிங் வைரஸின் தலைப்பு தீர்மானிக்கப்படுகிறது - ஹீமாக்ளூட்டினேஷன் எதிர்வினையை வழங்கும் பொருளின் மிக உயர்ந்த நீர்த்தல். இந்த அளவு வைரஸ் ஒரு ஹெமாக்ளூட்டினஸ் யூனிட்டாக (HAU) எடுத்துக்கொள்ளப்படுகிறது.RTGA ஐப் பயன்படுத்தி இன்ஃப்ளூயன்ஸா வைரஸ்களைக் கண்டறிதல்
இதைச் செய்ய, முதலில் வைரஸ் பொருளின் வேலை நீர்த்தலைத் தயாரிக்கவும், அதில் ஒரு குறிப்பிட்ட அளவு வைரஸின் 4 GAO உள்ளது.கட்டுப்பாட்டு கிணறுகளில் எரித்ரோசைட்டுகளின் வண்டல் உருவான பிறகு எதிர்வினை கணக்கில் எடுத்துக்கொள்ளப்படுகிறது. சோதனைக் கிணறுகளில் ஹீமாக்ளூட்டினேஷன் தாமதத்தால் ஒரு நேர்மறையான எதிர்வினை சுட்டிக்காட்டப்படுகிறது, இன்ஃப்ளூயன்ஸா வைரஸ்கள் பல்வேறு செல் கலாச்சாரக் கோடுகளைப் பயன்படுத்தி தனிமைப்படுத்தப்படலாம் - மனித கரு, குரங்கு சிறுநீரகங்கள், தொடர்ச்சியான நாய் சிறுநீரக செல் கோடு (MDCK) மற்றும் பிற. செல் கலாச்சாரங்களில், வைரஸ்களின் சைட்டோபதிக் விளைவு வெளிப்படுகிறது (ஸ்காலப் செய்யப்பட்ட விளிம்புகள், வெற்றிடங்கள், உள் அணு மற்றும் சைட்டோபிளாஸ்மிக் சேர்க்கைகளின் உருவாக்கம்), இது செல் மோனோலேயரின் சிதைவுடன் முடிவடைகிறது. தனிமைப்படுத்தப்பட்ட வைரஸ்களை அடையாளம் காண, RTGA பயன்படுத்தப்படுகிறது. (பண்பாடு திரவத்தில் ஹேமக்ளூட்டினின் டைட்டர் குறைந்தபட்சம் 1:8 ஆக இருந்தால்). இந்த எதிர்வினைக்கு கூடுதலாக, நீங்கள் RGGads ஐப் பயன்படுத்தலாம், இருப்பினும், இது குறைவான உணர்திறன் கொண்டது மற்றும் குறைந்தபட்சம் 1:160 நோய் எதிர்ப்பு சீரம் டைட்டர் மற்றும் RSK, RN, REMA போன்றவை தேவைப்படுகிறது.செரோலாஜிக்கல் ஆய்வு
இன்ஃப்ளூயன்ஸா நோயறிதலை உறுதிப்படுத்த செரோலாஜிக்கல் சோதனை பயன்படுத்தப்படுகிறது. இது நோயாளியின் சீரம் உள்ள ஆன்டிபாடி டைட்டரில் நான்கு மடங்கு அதிகரிப்பதைத் தீர்மானிப்பதை அடிப்படையாகக் கொண்டது.முதல் சீரம் நோயின் கடுமையான காலகட்டத்தில் (நோயின் 2-5-1 நாட்கள்), இரண்டாவது - 10-க்குப் பிறகு பெறப்படுகிறது. நோயின் 14 வது நாள். சீரம்கள் ஒரே நேரத்தில் கலக்கப்படலாம் என்பதால், அவற்றில் முதலாவது குளிர்சாதன பெட்டியில் -20 ° C வெப்பநிலையில் சேமிக்கப்படுகிறது. பெரும்பாலும், RTGA, RSK, RNGA ஆகியவை பயன்படுத்தப்படுகின்றன. இந்த எதிர்வினைகள் நிலையான வைரஸ் நோயறிதலின் சிறப்பு தொகுப்புகளுடன் செய்யப்படுகின்றன (பல்வேறு செரோலாஜிக்கல் வகைகளின் இன்ஃப்ளூயன்ஸா வைரஸின் குறிப்பு விகாரங்கள்). நோயாளி செராவில் குறிப்பிடப்படாத ஹீமாக்ளூட்டினேஷன் தடுப்பான்கள் இருப்பதால், அவை முதலில் 56 ° C வெப்பநிலையில் சூடேற்றப்படுகின்றன, மேலும் ஒரு சிறப்பு நொதி (உதாரணமாக, நியூராமினிடேஸ்) அல்லது பொட்டாசியம் பீரியடேட், ரிவனால், மாங்கனீசு குளோரைடு, வெள்ளை டயர் சஸ்பென்ஷன் போன்றவற்றின் தீர்வுகள் மூலம் சிகிச்சையளிக்கப்படுகின்றன. சிறப்பு திட்டங்களின்படி. மற்றும்ஹீமாக்ளூட்டினேஷன் தடுப்பு எதிர்வினை
ஹீமாக்ளூட்டினேஷன் தடுப்பு எதிர்வினை சோதனைக் குழாய்களில் (மேக்ரோடோமி) அல்லது நோயெதிர்ப்பு ஆய்வுகளுக்கான சிறப்புத் தட்டுகளில் செய்யப்படலாம், மென்மையான விளிம்புகள் கொண்ட சிவப்பு இரத்த அணுக்களின் கச்சிதமான, அடர்த்தியான வண்டல் உருவாகும்போது எதிர்வினை நேர்மறையாகக் கருதப்படுகிறது.எக்ஸ்பிரஸ் கண்டறிதல்
நேரடி அல்லது மறைமுக RIF இல் இம்யூனோஃப்ளோரசன்ஸைப் பயன்படுத்தி சோதனைப் பொருளில் குறிப்பிட்ட வைரஸ் ஆன்டிஜென்களை அடையாளம் காண்பதை அடிப்படையாகக் கொண்டது இந்த முறை. சளி நாசி பத்திகள் அல்லது குரல்வளையின் பின்புற சுவரில் இருந்து பெறப்படுகிறது, மையவிலக்கு மற்றும் ஸ்மியர்ஸ் சளி சவ்வின் நெடுவரிசை எபிடெலியல் செல்களின் வண்டலில் இருந்து கண்ணாடி ஸ்லைடுகளில் தயாரிக்கப்படுகிறது. அவை ஃப்ளோரோக்ரோம்களுடன் இணைக்கப்பட்ட இம்யூனோஃப்ளோரசன்ட் செராவுடன் சிகிச்சையளிக்கப்படுகின்றன, எடுத்துக்காட்டாக, எஃப்ஐடிசி (ஃப்ளோரெசின் ஐசோதியோசயனேட்). ஃப்ளோரசன்ட் நுண்ணோக்கியைப் பயன்படுத்தி மருந்துகளை ஆய்வு செய்யும் போது, இன்ஃப்ளூயன்ஸா வைரஸ்களின் பச்சை-மஞ்சள் பளபளப்பு காணப்படுகிறது, அவை நோயின் தொடக்கத்தில் எபிடெலியல் செல்களின் கருக்களில் உள்ளூர்மயமாக்கப்படுகின்றன.சமீபத்தில், ELISA, RZNGA மற்றும் PCR ஐப் பயன்படுத்த முன்மொழியப்பட்டது. குறிப்பிட்ட வைரஸ் ஆன்டிஜென்களைக் குறிக்க.உறிஞ்சுதல்
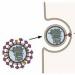
பிரபலமான "H5N1" என்பது "ஹெமாக்ளூட்டினின் வகை ஐந்து, நியூராமினிடேஸ் வகை ஒன்று" - இந்த இரண்டு புரதங்களும் இன்ஃப்ளூயன்ஸா வைரஸின் மேற்பரப்பில் ஒட்டிக்கொள்கின்றன (படம் 1 இல், ஹேமக்ளூட்டினின் பச்சை மற்றும் நியூராமினிடேஸ் சாம்பல் நிறத்தில் உள்ளது).
ஹெமாக்ளூட்டினின் உதவியுடன், இன்ஃப்ளூயன்ஸா வைரஸ் செல்கள் மேற்பரப்பில் உள்ள ஏற்பிகளுடன் இணைகிறது. வைரஸின் ஆரம்ப இலக்கு சுவாசக் குழாயின் சிலியேட்டட் எபிட்டிலியத்தின் செல்கள் ஆகும், ஆனால் அதனால்தான் நாம் அதை விரும்புவதில்லை: இரத்த சிவப்பணுக்கள் உட்பட பல உயிரணுக்களின் ஏற்பிகளுடன் ஹேமக்ளூட்டினின் இணைக்க முடியும். ஒரு வைரஸ் ஒரே நேரத்தில் இரண்டு (அருகிலுள்ள) இரத்த சிவப்பணுக்களுடன் இணைந்தால், இரத்த சிவப்பணுக்கள் ஒன்றாக ஒட்டிக்கொள்ளும்! எனவே புரதத்தின் பெயர் - "இரத்த ஒட்டுதல்".
அரிசி. 1
செயல்படுத்தல்
முட்டாள் உயிரணு தன்னுடன் இணைந்திருக்கும் வைரஸை பாகோசைட்டோசிஸ் மூலம் உறிஞ்சுகிறது - விரும்புகிறது, அதை சாப்பிடுகிறது. ஏன், குழந்தைகள் ஏன் எல்லா வகையான கேவலமான விஷயங்களையும் தங்கள் வாயில் வைக்கிறார்கள்?! இருப்பினும், வைரஸ் உயிரணுவிற்குள் உணவாக, ஒரு பாகோசைட்டோடிக் வெசிகிளுக்குள் உள்ளது (படம் 2 இல் - "எண்டோசோம்"). எண்டோசோம் லைசோசோமுடன் இணைகிறது, ஒரு செரிமான வெற்றிடத்தை உருவாக்குகிறது, ஒரு அமில சூழலை உருவாக்க சைட்டோபிளாஸில் இருந்து புரோட்டான்கள் செலுத்தப்படுகின்றன (இந்த செயல்முறை படம் 2 இல் காட்டப்பட்டுள்ளது) - இன்னும் கொஞ்சம், மேலும் நாம் வைரஸை ஜீரணிப்போம் (உடன் வார்த்தைகள் "புரத உணவு, என்ன வித்தியாசம்").

அரிசி. 2
ஆடை அவிழ்ப்பு
ஆனால் இந்த நிகழ்வுகளுக்கு வைரஸ் தயாராக உள்ளது:
 அரிசி. 3 |
- Hemagglutinin ஒரு அமில சூழலின் செல்வாக்கின் கீழ் மாற்றியமைக்கப்படுகிறது - அதன் மேற்பரப்பு ஹைட்ரோஃபிலிக் ஆகிறது, மேலும் அது (முன்பு எண்டோசோம் சவ்வின் உள் மேற்பரப்பில் உள்ள ஏற்பியுடன் இணைக்கப்பட்டுள்ளது, இப்போது) இந்த சவ்வுக்குள் உட்பொதிக்கப்பட்டுள்ளது.
- எண்டோசோமுக்குள் உந்தப்பட்ட புரோட்டான்கள் சிறப்பு சேனல் புரதங்கள் (படம் 1 மற்றும் படம் 3 இல் சுட்டிக்காட்டப்பட்ட M2 புரதங்கள்) வழியாக வைரஸின் லிப்பிட் ஷெல் வழியாக சென்று வைரஸின் புரத ஷெல்லை அடைகிறது (படம் 1 இல் - வெள்ளை பந்துகளின் வட்டம் - M1 புரதங்கள்). இதன் காரணமாக, புரோட்டீன் ஷெல் அழிக்கப்படுகிறது (படம் 3 இல், அழிக்கப்பட்ட புரத ஷெல்லின் M1 புரதங்கள் சிவப்பு நட்சத்திரங்களாகக் குறிக்கப்படுகின்றன).
- வைரஸின் லிப்பிட் உறை (ஹேமக்ளூட்டினின் ஊடுருவல் நடவடிக்கை காரணமாக) பாகோசோமின் (லிப்பிட்) சவ்வுடன் இணைகிறது; வைரஸின் ஆர்என்ஏ செல்லின் சைட்டோபிளாஸில் முடிவடைகிறது.
வைரஸ் பிரதிபலிப்பு
சைட்டோபிளாஸில் வெளியிடப்படும் வைரஸ் ஆர்என்ஏ முற்றிலும் பாதுகாப்பானது.
- அதில் புரதங்களை உருவாக்க முடியாது, ஏனெனில் இது மைனஸ் ஆர்என்ஏ (புரதங்கள் அதன் மூலம் குறியாக்கம் செய்யப்படவில்லை, ஆனால் நிரப்பு பிளஸ் ஸ்ட்ராண்ட், இது இன்னும் இல்லை).
- அதன் மீது ஆர்என்ஏவை உருவாக்குவதும் சாத்தியமற்றது - நமது செல்கள் பொதுவாக ஆர்என்ஏவை இரட்டிப்பாக்கும் என்சைம் இல்லை.
"ஓ-ஹோ-ஹோ, உங்களிடம் எதுவும் இல்லை," காய்ச்சல் வைரஸ் முணுமுணுத்து, மீசையுடைய தலையை ஆட்டியது, "ஆனால் பரவாயில்லை, எல்லாவற்றையும் என்னுடன் கொண்டு வந்தேன்." வைரஸ் தன்னுடன் PB1, PB2 மற்றும் PA என்ற புரதங்களைக் கொண்டு வந்தது, இவை அனைத்தும் சேர்ந்து வைரஸ் RNA-சார்ந்த RNA பாலிமரேஸை உருவாக்குகின்றன - இது RNA ஐ நகலெடுக்கும். ஆனால் துரதிர்ஷ்டம்! எந்த பாலிமரேஸுக்கும் வேலை செய்ய ஒரு ப்ரைமர் தேவை, ஆனால் மறதி காய்ச்சல் அதை எடுத்துக் கொள்ளவில்லை! எல்லாம் முடிந்ததா?!
அமைதியாக இரு, பீதி அடையாதே! - இந்த வார்த்தைகளால், முழு நிறுவனமும் (8 வைரஸ் ஆர்என்ஏக்கள் மற்றும் 3 வைரஸ் என்சைம்கள்) செல் கருவுக்கு அனுப்பப்படுகிறது. அங்கு காய்ச்சல் முழு சேவையைப் பெறுகிறது:
- வைரஸ் ஆர்என்ஏ நகலெடுப்புக்கான ப்ரைமர்கள் (பிளஸ் ஆர்என்ஏவைப் பெற) செல்லுலார் ஆர்என்ஏவில் இருந்து பிரிக்கப்பட்ட பிரிவுகளாகும்;
- செயலாக்கம்: ஆர்என்ஏ தொகுப்புக்கான ப்ரைமர்களாக செயல்பட்ட பிரிவுகள் - இவை தொப்பிகள், எனவே 5" முனையின் மாற்றம் ஆரம்பத்திலேயே மேற்கொள்ளப்பட்டது; தொகுப்பின் முடிவில், 3" முனையின் பாலிடெலேஷன் ஏற்படுகிறது;
- பிளவுபடுதல்: இரண்டு புரதங்களுக்கான தகவல்களைக் கொண்ட சில வைரஸ் ஆர்என்ஏ இரண்டு பகுதிகளாக வெட்டப்படுகிறது.
இந்த வழியில், பிளஸ் ஆர்என்ஏக்கள் ஒருங்கிணைக்கப்படுகின்றன, இது வைரஸ் புரதங்கள் மற்றும் வைரஸ் மைனஸ் ஆர்என்ஏக்களின் தொகுப்புக்கான டெம்ப்ளேட்களாக செயல்படும்.
பின்னர் எல்லாம் எளிது: முட்டாள் செல், அதன் சொந்த அமினோ அமிலங்களிலிருந்து அதன் சொந்த ரைபோசோம்களைப் பயன்படுத்தி, வைரஸின் புரதங்களை ஒருங்கிணைக்கிறது, இதில் ஆர்என்ஏ சார்ந்த ஆர்என்ஏ பாலிமரேஸ் அடங்கும். இன்ஃப்ளூயன்ஸா மைனஸ் ஆர்என்ஏவும் அணுக்கருவிற்குள் தீவிரமாக உற்பத்தி செய்யப்படுகிறது. வைரஸ் துகள்களின் அசெம்பிளி சைட்டோபிளாஸில், செல் மென்படலத்தின் உள் மேற்பரப்பில் நிகழ்கிறது. முடிக்கப்பட்ட வைரஸ் எக்சோசைடோசிஸ் (புடிங்) மூலம் செல்லை விட்டு வெளியேறுகிறது, நியூராமினிடேஸ் செல்லையும் புதிதாகப் பிறந்த வைரஸையும் இணைக்கும் கடைசி நூலைக் கடிக்கிறது... ஒரு புதிய (தீய) சிறிய உயிர் உலகில் வெளிவருகிறது!

அரிசி. 4
K. SOLTISSEK மற்றும் H.-D. KLENK (SN. SCHOLTISSEK, H.-D. KLENK)
முன்னுரை
இன்ஃப்ளூயன்ஸா வைரஸ் நகலெடுப்பின் சிக்கல் குறித்து பல மதிப்புரைகள் உள்ளன. 1968 க்கு முந்தைய இலக்கியங்கள் ஹோய்ல் (1968) மற்றும் ஸ்கோல்டிசெக் (1969) ஆகியோரின் கட்டுரைகளில் சுருக்கப்பட்டுள்ளன; சமீபத்திய படைப்புகளில் வைட் (1973) மற்றும் கம்பன்ஸ் மற்றும் சோப்பின் (1974) ஆகியோரின் மதிப்புரைகளும் அடங்கும்.
இன்ஃப்ளூயன்ஸா வைரஸ் வகை A பற்றிய ஆய்வில் இருந்து பிரதியெடுப்பு பற்றிய பெரும்பாலான தரவுகள் பெறப்பட்டன. மற்ற வகை இன்ஃப்ளூயன்ஸா வைரஸின் நகலெடுக்கும் வழிமுறைகளில் குறிப்பிடத்தக்க வேறுபாடுகள் இன்னும் கண்டறியப்படவில்லை.
MDBK செல்களில் (Choppin, 1969) இன்ஃப்ளூயன்ஸா வைரஸின் WSN திரிபு பரவுதல் அல்லது குஞ்சு கரு ஃபைப்ரோபிளாஸ்ட் உயிரணுக்களில் கோழி பிளேக் வைரஸ் (FPV) பரவுதல் போன்ற பல செல் கலாச்சார அமைப்புகள் பரவலாகப் பரவியுள்ளன. ஒரு ஒற்றை சுழற்சியில் கடைசி வைரஸின் வளர்ச்சி வளைவுக்கான எடுத்துக்காட்டு 30 இல் நிரூபிக்கப்பட்டுள்ளது, அங்கு மறைந்திருக்கும் காலம் தோராயமாக 3 மணிநேரம் மற்றும் வைரஸ் உற்பத்தி 8 முதல் 12 மணிநேரங்களுக்கு இடையில் ஒரு பீடபூமியை அடைகிறது. பொதுவாக, இத்தகைய செல் அமைப்புகளில் அதிக மகசூல் கிடைக்கும். தொற்று வைரஸ்கள் காணப்படுகின்றன, மேலும் செல்லுலார் புரதங்களின் தொகுப்பு நோய்த்தொற்றுகளுக்குப் பிறகு மிகவும் திறம்பட ஒடுக்கப்படுகிறது. எனவே, இத்தகைய அமைப்புகள் உயிர்வேதியியல் ஆராய்ச்சிக்கு மிகவும் வசதியானவை.
II. வைரஸின் உறிஞ்சுதல், ஊடுருவல், "ஸ்ட்ரிப்பிங்"
வைரஸுடன் ஒரு கலத்தின் தொற்று உறிஞ்சுதலுடன் தொடங்குகிறது, அதாவது செல் மேற்பரப்பில் வைரஸ் துகள் இணைக்கப்படுகிறது. இணைப்புக்கு, இரண்டு நிரப்பு கட்டமைப்புகள் தேவை, அதாவது: செல் மேற்பரப்பில் உள்ள ஏற்பி தளங்கள் மற்றும் இந்த ஏற்பி தளங்களை அடையாளம் காணும் வைரஸ் கூறுகள். காய்ச்சல் வைரஸின் பல்வேறு தோற்றம் கொண்ட எரித்ரோசைட்டுகளுடன் தொடர்புகொண்டு அவற்றைத் திரட்டும் திறன் பல ஆண்டுகளாக அறியப்படுகிறது. (Hirst, 1941; McClelland, Hare, 1941) செல் மேற்பரப்புடன் இன்ஃப்ளூயன்ஸா வைரஸின் தொடர்புக்கு ஹெமாக்ளூட்டினேஷன் ஒரு மாதிரி எதிர்வினையாகப் பயன்படுத்தப்பட்டது. எவ்வாறாயினும், எரித்ரோசைட்டுகளின் மேற்பரப்பு மற்றும் பாதிக்கப்பட்ட உயிரணுக்களின் மேற்பரப்பு ஆகியவற்றின் கட்டமைப்புகள் முற்றிலும் வேறுபட்டதாக இருக்கும் என்பதால், பொதுமைப்படுத்தல்களில் மிகவும் கவனமாக இருக்க வேண்டும் (அத்தியாயம் 3 ஐயும் பார்க்கவும்).
A. உறிஞ்சுதலில் ஹீமாக்ளூட்டினினின் பங்கு
பிணைப்பில் ஈடுபடும் விரியன் கூறு HA* "ஸ்பைக்" ஆகும். நோய்த்தொற்றின் தொடக்கத்தில் வைரஸ் β-புரதங்களின் பங்கு இரண்டு மேற்பரப்பு புரதங்களுக்கு குறிப்பிட்ட ஆன்டிபாடிகளைப் பயன்படுத்தி ஆய்வு செய்யப்பட்டது: HA* மற்றும் NA*. இந்த ஆன்டிபாடிகளை மறுசீரமைப்பு வைரஸ்களைப் பயன்படுத்தி பெறலாம். எடுத்துக்காட்டாக, AO மற்றும் A2 வைரஸ்களுக்கு இடையேயான ஒரு குறுக்கு HA*, AO, மற்றும் NA* A2 (Kilbourne et al., 1968) ஆகியவற்றைக் கொண்டு செல்லும் X7F1 மறுசீரமைப்பை உருவாக்குகிறது. X7F1 வைரஸிற்கான ஆன்டிசெரம் AO வகை இன்ஃப்ளூயன்ஸா வைரஸ்களின் NA* ஐத் தடுக்காது, ஆனால் ஹெமாக்ளூட்டினேஷனைத் தடுக்கிறது மற்றும் இந்த வகை வைரஸ்களின் தொற்றுநோயை நடுநிலையாக்குகிறது. இன்ஃப்ளூயன்ஸா A2 வைரஸ்களுடனான அதே சீரம் இடைவினையானது ஹெமாக்ளூட்டினேஷன் அல்லது தொற்றுநோயைத் தடுக்காது, இருப்பினும் NA* செயல்பாட்டின் நடுநிலைப்படுத்தல் முடிந்தது. எனவே, நோய்த்தொற்றின் தொடக்கத்தில் NA* ஈடுபடவில்லை, மேலும் NA* மட்டுமே உறிஞ்சுதலுக்கு பொறுப்பாகத் தோன்றுகிறது. புரோட்டியோலிடிக் என்சைம்களால் நியூராமினிடேஸ் "ஸ்பைக்குகள்" மட்டுமே அகற்றப்பட்ட வைரஸ் துகள்கள் தொற்றுநோயாகவே இருக்கின்றன என்ற தரவுகளால் இந்த கருத்து ஆதரிக்கப்படுகிறது (ஷுல்ஸ், 1970).
கார்போஹைட்ரேட்டுகள் நிறைந்த HA* "ஸ்பைக்" இன் வெளிப்புற பகுதியில் ஹெமாக்ளூட்டினேட்டிங் பகுதி உள்ளூர்மயமாக்கப்பட்டதற்கான சான்றுகள் உள்ளன (அத்தியாயம் 3 ஐப் பார்க்கவும்). கார்போஹைட்ரேட்டுகள் HA* செயல்பாட்டிற்கு இன்றியமையாததாகத் தோன்றுகிறது, ஏனெனில் கிளைகோசைலேட்டட் அல்லாத HA* புரதங்கள் இரத்த சிவப்பணுக்களுடன் பிணைக்க முடியாது (க்ளெங்க் மற்றும் பலர், 1972b).
பி. காய்ச்சல் வைரஸ் ஏற்பி
கார்போஹைட்ரேட்டுகள் ஹெமாக்ளூட்டினின் இன்றியமையாத அங்கமாகும், ஆனால் செல் மேற்பரப்பில் உள்ள வைரஸ் ஏற்பியின் ஒரு முக்கிய அங்கமாகும்.ஹிர்ஸ்ட் (1942) வைரஸ்-எரித்ரோசைட் வளாகம் நிலையற்றது மற்றும் உயிரணுவின் மேற்பரப்பில் உள்ள ஏற்பி வைரஸ் நொதியால் அழிக்கப்படுவதைக் கவனித்தார். பின்னர் காட்டப்பட்டது போல், இந்த நொதி நியூராமினிடேஸ் ஆகும், இது கிளைகோபுரோட்டீன்களில் இருந்து நியூராமிக் அமிலத்தை பிளவுபடுத்துகிறது (க்ளெங்க் மற்றும் பலர், 1955; க்ளெங்க், ஸ்டோஃபெல், 1956; காட்ஸ்சாக், 1957) இது ஒரு ஒருங்கிணைந்த ஒரு நொதியின் முதல் நிரூபணம் ஆகும். ஒரு வைரஸ் துகள்.பாக்டீரியல் நியூராமினிடேஸ்கள் இன்ஃப்ளூயன்ஸா வைரஸ் ஏற்பிகளையும் அழிக்கும் திறன் கொண்டவை (பர்னெட், ஸ்டோன், 1947) எனவே, இன்ஃப்ளூயன்ஸா வைரஸின் ஏற்பி நியூராமினிக் அமிலம் கொண்ட கிளைகோபுரோட்டீன் என்று கண்டறியப்பட்டது.
அதன்பிறகு, ஏராளமான தகவல்கள் குவிந்துள்ளன
myxovirus ஏற்பி பற்றி, சமீபத்தில் ஒரு மதிப்பாய்வில் சுருக்கமாக
ஹியூஸ் (1973). பெறப்பட்ட தரவு சுருக்கமாக பின்வருமாறு:
ஊதுகிறது ஏற்பி பகுதிகளில் நியூரோமியின் எச்சங்கள் உள்ளன.
அயோயிக் அமிலம், இது கார்போஹைட்ரேட் சங்கிலிகளில் உள்ளது
கிளைகோபுரோட்டின்கள். நியூரோமியின் ஆக்ஸிஜனேற்றமற்ற முனைய எச்சங்கள்-
வைரஸ்களுடன் கிளைகோபுரோட்டின்களின் தொடர்புக்கு nosnla அவசியம்
ரஸ் காய்ச்சல். நியூராமினிடேஸ் சிகிச்சை முற்றிலும் நீக்குகிறது
பிணைப்பு செயல்பாடு. உடன் சீரழிவு ஆய்வுகள் ஆகும்
பீரியடேட்டைப் பயன்படுத்தி, இணைப்பதற்கு என்று கருதப்படுகிறது
செயல்பாட்டிற்கு அப்படியே நியூராமைன் மூலக்கூறு தேவைப்படுகிறது
அமிலங்கள் (சுட்டாஜித் மற்றும் வின்ஸ்லர், 1971). கார்பாக்சில் குழு,
ஒருவேளை இது ஒரு முக்கிய பங்கு வகிக்கிறது, ஏனெனில் அது அவசியம்
வெளிப்படையாக, மற்றும் மின்னியல் சக்திகள் (ஹுவாங், 1974).
பலவீனமான மசாலா மட்டுமே இருப்பதாகத் தெரிகிறது
உடலமைப்புடன் தொடர்புடைய அமைப்புடன் தொடர்புடையது
நியூராமினிக் அமிலம், அது முழுவதும் காட்டப்பட்டுள்ளது
ஜெய்ராமினிக் அமிலம் கொண்ட கிளைகோபுரோட்டின்களின் தொகுப்பு,
myxoviruses உடன் பிணைக்கிறது. மேலும், கேங்க்லியோசைடுகள் (கிளை-
இந்த விஷயத்தில் செயலில் உள்ளன (ஹேவுட், 1975).
ரிசெப்டரின் மூலக்கூறு அமைப்பு நிறுவப்பட்டவுடன், இன்ஃப்ளூயன்ஸா வைரஸ் பிணைப்பின் பிரச்சினை இன்னும் தெளிவாகிவிடும் என்று நம்பப்படுகிறது. ஓரளவிற்கு இது ஏற்கனவே எரித்ரோசைட்டுகளின் விஷயத்தில் அடையப்பட்டுள்ளது (Marchesi et al., 1973). செயற்கை சவ்வுகளுடன் myxoviruses இணைக்கப்படுவதைப் படிப்பதன் மூலம் கூடுதல் தகவல்களும் வழங்கப்படலாம் (Tiffany and Blough, 1971).
B. ஊடுருவல் மற்றும் "நீக்குதல்" சாத்தியமான வழிமுறைகள்
இரண்டு வெவ்வேறு "ஊடுருவல் மற்றும் "உடைகளை அவிழ்த்தல்" இன்ஃப்ளூயன்ஸா வைரஸ் மட்டுமல்ல, பொதுவாக வெளிப்புற ஷெல் கொண்ட வைரஸ்களும் முன்மொழியப்பட்டுள்ளன.இரண்டு பார்வைகளும் முக்கியமாக எலக்ட்ரான் மைக்ரோ ட்ரெஞ்ச் ஆய்வுகளை அடிப்படையாகக் கொண்டவை. இந்த வழிமுறைகளில் ஒன்று பிபினோசைட்டோசிஸின் செயல்முறையாக நம்பப்படும் வைரோனெக்சிஸ், பினோசோம்களில் வைரஸ் துகள்கள் சேர்க்கப்படும் போது, அவை லைசோசோம்களுடன் ஒன்றிணைகின்றன, மேலும் லைசோசோம் என்சைம்கள் வைரஸின் "உடைகளை அவிழ்க்க" காரணமாகின்றன (Fazekas de St. Grot, 1948) எலக்ட்ரான் நுண்ணோக்கி உறுதிப்படுத்தல் டேல்ஸ் மற்றும் சோப்பின் (1962) மற்றும் டூர்மாஷ்கின் மற்றும் டைரெல் (1970) ஆகியோரின் படைப்புகளில் இந்தக் கண்ணோட்டம் பெறப்பட்டது. நோய்த்தொற்றுக்குப் பிறகு 10 நிமிடங்களில், வைரஸ் துகள்கள் செல் மேற்பரப்புடன் நேரடியாகத் தொடர்பு கொள்ளப்பட்டன, மேலும் 20 நிமிடங்களில் துகள்கள் காணப்பட்டன. சைட்டோபிளாஸ்மிக் வெற்றிடங்களுக்குள் கண்டறியப்பட்டது.மோர்கன் மற்றும் ரோஸ் (1968) மேற்கொண்ட இந்த ஆய்வுக்கு மாறாக, வைரஸ் உறை புரவலன் உயிரணு சவ்வுடன் இணைவதால் நுழைவு ஏற்படக்கூடும் என்று தெரிவிக்கிறது.எனவே, இன்ஃப்ளூயன்ஸா வைரஸ் நுழைவதற்கான வழிமுறை குறித்து தற்போது ஒருமித்த கருத்து இல்லை.
அத்தியாயத்தில் விவரிக்கப்பட்டுள்ளபடி. 5, இன்ஃப்ளூயன்ஸா வைரஸ் விரியன்கள் அவற்றின் ரைபோநியூக்ளியோபுரோட்டீன் கூறுகளுடன் தொடர்புடைய ஆர்என்ஏ பாலிமரேஸைக் கொண்டிருக்கின்றன.எனவே, "உடைகளை அகற்றும்" செயல்முறையானது ரிபோநியூக்ளியோபுரோட்டீன் வெளியீட்டின் செயல்முறையிலிருந்து இடஞ்சார்ந்த முறையில் பிரிக்கப்பட வாய்ப்பில்லை.இந்த நிலை செல் மேற்பரப்பில் நிகழ்கிறது. சவ்வு இணைவு, மற்றும் பாகோசைடிக் வெசிகிள்களில், வைரோஹெக்சிஸ் பொறிமுறையின் படி.
III. டிரான்ஸ்கிரிப்ஷன் A. ஆர்என்ஏ சின்தஸிஸ் வரிசை
"உடைகளை அவிழ்த்த பிறகு," வைரியனின் sRNA நிரப்பு RNA ஆக மாற்றப்பட வேண்டும், தொற்று துகள்களுடன் அறிமுகப்படுத்தப்பட்ட RNA பாலிமரேஸ் வைரஸ் பரவலின் முதல் கட்டத்தில் செயல்பட வேண்டும் (அத்தியாயம் 5 ஐப் பார்க்கவும்). இன்ஃப்ளூயன்ஸா வைரஸ் மரபணுவை வடிவில் மட்டுமே விரியன்களில் இருந்து தனிமைப்படுத்த முடியும்
தனித்தனி துண்டுகள் (அத்தியாயம் 6 ஐப் பார்க்கவும்). மேலும், மரபணு பகுப்பாய்வு (அத்தியாயம் 7) மற்றும் ஒரு தொற்று வைரஸ் (Scholtissek, Rott, 1964) படிப்படியாக செயலிழக்கச் செய்வதன் மூலம் காட்டப்பட்டுள்ளபடி, இது தனித்தனி துண்டுகளின் வடிவத்தில் செயல்படுகிறது. ஒவ்வொரு தனித் துண்டிலும் உள்ள ஆர்.என்.ஏ. கலத்தில் ஒரு கட்டற்ற மூலக்கூறாக இல்லை, ஆனால் எப்போதும் புரதத்துடன் அணிந்திருப்பதால், கேள்வி எழுகிறது: வைரஸ் ஆர்.என்.ஏ அதன் நகலெடுக்கும் போது என்ன புரதத்துடன் தொடர்புடையது?
இன்ஃப்ளூயன்ஸா வைரஸின் ஆர்என்ஏவின் தொகுப்பை ஆய்வு செய்வதற்கான சோதனைகள் பெரும் சிரமங்களை ஏற்படுத்துகின்றன, ஏனெனில் ஆக்டினோமைசின் டி, குறிப்பாக செல்லுலார் ஆர்என்ஏவின் தொகுப்பை அடக்கும் போது வைரஸ் ஆர்என்ஏ உற்பத்தியைக் கண்டறிய பயன்படுத்த முடியாது, ஏனெனில் இந்த ஆண்டிபயாடிக் இன்ஃப்ளூயன்ஸா வைரஸின் இனப்பெருக்கத்தை அடக்குகிறது ( பாரி மற்றும் பலர், 1962 ; ராட், ஸ்கோல்டிசெக், 1964; பாரி மற்றும் பலர், 1965; பொன்ஸ், 1967). இந்த காரணத்திற்காக, ஆர்என்ஏ தொகுப்பின் நேர வரிசையை தீர்மானிக்க, லேபிளிடப்படாத விஆர்என்ஏ அல்லது விசிஆர்என்ஏ அதிகமாக உள்ள நோய்த்தொற்றுக்குப் பிறகு பல்வேறு புள்ளிகளில் பல்ஸ்-லேபிளிடப்பட்ட ஆர்என்ஏவின் குறிப்பிட்ட கலப்பினம் பயன்படுத்தப்பட்டது, அதைத் தொடர்ந்து ஆர்நேஸ் (ஸ்கோல்டிசெக் மற்றும் ரோட், 1970) சிகிச்சை பயன்படுத்தப்பட்டது. தொற்று சுழற்சியின் ஆரம்ப கட்டங்களில், vcRNA தொகுப்பு நிலவியது, நோய்த்தொற்று ஏற்பட்ட இரண்டாவது மணி நேரத்தில் அதிகபட்சமாக அடையும், அதேசமயம் பிற்கால கட்டங்களில், பெரும்பாலான வைரஸ் சார்ந்த RNA ஆனது vRNA ஆனது. க்ரூக் (1972), ஒரு வித்தியாசமான முறையைப் பயன்படுத்தி, நோய்த்தொற்றுக்குப் பிறகு 4 மணிநேரத்திற்குப் பிறகு, BIKRNA தொகுப்பு முற்றிலும் நின்றுவிடுகிறது. பீனால் பிரித்தெடுத்த பிறகு, ஒப்பீட்டளவில் சிறிய அளவு lncRNA கண்டறியப்பட்டது (Scholtissek and Rott, 1970).
ஒன்று அல்லது மற்றொரு வகை வைரஸ் ஆர்என்ஏவில் தகவல் செயல்பாடுகள் மற்றும் வைரஸ் புரதங்களின் தொகுப்புக்கான டெம்ப்ளேட்டாகப் பயன்படுத்தப்படுகிறது (பிரிவு IVA ஐப் பார்க்கவும்), வைரஸ் ஆர்என்ஏவின் வேறுபட்ட கேடபாலிசத்தின் மட்டத்தில் சில மொழிபெயர்ப்புக் கட்டுப்பாடுகள் இருக்கலாம். எனவே, இன்ஃப்ளூயன்ஸா வைரஸ் ஆர்என்ஏவின் நிலைத்தன்மையை விவோவில் ஆய்வு செய்ய துடிப்பு-துரத்தல் சோதனைகள் மேற்கொள்ளப்பட்டன. செல்லுலார் ஆர்என்ஏவிற்கு மாறாக, இரண்டு வகையான வைரஸ் ஆர்என்ஏவும் 90 நாள் காலத்தில் முற்றிலும் நிலையாக இருக்கும் என்று நிறுவப்பட்டுள்ளது (ஸ்கோல்டிசெக் மற்றும் பலர்., 1972).
முன்னதாக, vivoவில் வைரஸ் ஆர்என்ஏவின் தொகுப்பைப் படிக்கும் போது, தொற்று சுழற்சியின் பிற்பகுதியில் ஆக்டினோமைசின் டி சேர்க்கப்பட்டபோது (டூஸ்பெர்க் மற்றும் ராபின்சன், 1967; நாயக், 1970; மா-ஹை, 1970), அவர்கள் அதை கணக்கில் எடுத்துக்கொள்ளவில்லை. ஆன்டிபயாடிக் குறிப்பாக விவோவில் நிரப்பு ஆர்என்ஏவின் தொகுப்பைத் தடுக்கிறது (ஸ்கோல்டிசெக் மற்றும் ரோட், 1970; போன்ஸ், 1973). lncRNA பாதிக்கப்பட்ட உயிரணுக்களிலிருந்து குறைந்தது ஐந்து தனித்தனி துண்டுகளாக வெளியிடப்படுவதால், வைரஸ் RNA துண்டுகளின் வடிவத்திலும் ஒருங்கிணைக்கப்படுகிறது (Pons and Hirst, 1968).
பி. புரவலன் கலத்தின் உள்ளே வைரஸ் ஆர்என்ஏ தொகுப்பின் உள்ளூர்மயமாக்கல்
ஆட்டோரேடியோகிராஃபி மூலம் பெறப்பட்ட தரவுகளிலிருந்து, வைரஸ் ஆர்என்ஏ தொகுப்பின் தளம் செல் கருவாகத் தோன்றுகிறது என்று முடிவு செய்யப்பட்டது (ஸ்கோல்டிசெக் மற்றும் பலர், 1962; பாரி மற்றும் பலர்., 1974). இந்த ஆய்வுகளில் பயன்படுத்தப்படும் துடிப்பு காலங்கள் இன்னும் நீண்டதாக இருந்ததால், வைரஸ் ஆர்என்ஏ உயிரணுவின் சைட்டோபிளாஸில் ஒருங்கிணைக்கப்பட்டு பின்னர் அணுக்கருவிற்கு கொண்டு செல்லப்படுகிறது, அங்கு அது குவிந்துவிடும் என்பதை விலக்க முடியாது. கூடுதலாக, விஆர்என்ஏ மற்றும் சிஆர்என்ஏவை கலத்தில் வெவ்வேறு இடங்களில் ஒருங்கிணைக்க முடியும்.
பி. வைரல் ஆர்என்ஏ தொகுப்புக்கான தடுப்பு 1. ஆக்டிமோமைசின் டி, மித்ராமைசின் மற்றும் ஏ-அமனிடின்
டிஎன்ஏ டெம்ப்ளேட் செயல்பாட்டில் குறுக்கிடும் ஆக்டினோமைசின் டி அல்லது மித்ராமைசின், வைரஸ் ஆர்என்ஏ-சார்ந்த ஆர்என்ஏ பாலிமரேஸ் ஏற்கனவே இருக்கும் நேரத்தில் பாதிக்கப்பட்ட செல்களில் சேர்க்கப்படும் போது (உதாரணமாக, தொற்றுக்கு 2 மணி நேரம் கழித்து), விஆர்என்ஏ தோராயமாக மேலும் 2 வரை ஒருங்கிணைக்கப்படுகிறது. இருப்பினும், VcRNA உற்பத்தி உடனடியாக நிறுத்தப்படும். பின்னர், vRNA தொகுப்பும் குறைகிறது, இது vRNA இன் தொடர்ச்சியான உருவாக்கம் தேவை என்பதைக் குறிக்கிறது (Rott et al., 1965; Scholtissek and Rott, 1970; Scholtissek et al., 1970; Pons, 1973). கிரிகோரியாட்ஸ் (1970) ஆக்டினோமைசின் டி, நோய்த்தொற்று சுழற்சியின் பிற்பகுதியில் சேர்க்கப்படும் போது vRNA தொகுப்பில் வலுவான விளைவைக் கொண்டுள்ளது என்பதைக் காட்டுகிறது. இந்த சோதனைகளில், வைரஸ் ஆர்என்ஏவின் தொகுப்பு, பாதிக்கப்பட்ட உயிரணுக்களின் மொத்த ஆர்என்ஏவில் யூரிடைன் என்று பெயரிடப்பட்டதை அதிகரிப்பதன் மூலம் தீர்மானிக்கப்பட்டது. இந்த அதிகரிப்பு ஆக்டினோமைசின் டி சேர்ப்பதன் மூலம் அகற்றப்படலாம். இருப்பினும், இன்ஃப்ளூயன்ஸா வைரஸ் தொற்று நோய்த்தொற்றுக்குப் பிறகு செல்லில் யூரிடின் என்று பெயரிடப்பட்டதைச் சேர்ப்பதில் அதிகரிப்பை ஏற்படுத்துகிறது என்பதை நினைவில் கொள்ள வேண்டும் (ஸ்கோல்டிசெக் மற்றும் பலர்., 1967) மற்றும் ஆக்டினோமைசின் டி இந்த ஒருங்கிணைப்பில் ஒரு தடுப்பு விளைவைக் கொண்டிருக்கிறது (Scholtissek et al., 1967). ., 1969). siAmanitin, DNA உடன் எந்தத் தொடர்பையும் கொண்டிருக்கவில்லை, செல்லுலார் RNA பாலிமரேஸ்களில் ஒன்றின் (RNA Podimerase II) செயல்பாட்டை பாதிக்கிறது, மேலும் தொற்றுக்குப் பிறகு உடனடியாக கலாச்சார திரவத்தில் சேர்க்கப்படும் போது cRNAயின் தொகுப்பைத் தடுக்கிறது (Rott and Scholtissek, 1970; Mahy et அல்., 1972).
இந்த நுண்ணுயிர் எதிர்ப்பிகளால் cfRNA தொகுப்பின் குறிப்பிட்ட தடுப்பின் வழிமுறை முற்றிலும் தெளிவாக இல்லை, ஏனெனில் அவை விட்ரோவில் cfRNA உருவாவதை பாதிக்காது.இதனால், இந்த நுண்ணுயிர் எதிர்ப்பிகள் விவோவில் மட்டுமே செயல்படுகின்றன, இருப்பினும் cfRNA ஐ ஒருங்கிணைக்கும் நொதியை உயிரணுக்களிலிருந்து தனிமைப்படுத்த முடியும். நோய்த்தொற்றுக்குப் பிறகு 2 மணிநேரம், ஆக்டினோமைசின் டி சேர்க்கப்பட்டது (ஸ்கோல்டிசெக் மற்றும் ராட், 1969a).
இன்ஃப்ளூயன்ஸா வைரஸ்களின் இனப்பெருக்கம் ஹோஸ்ட் செல் டிஎன்ஏ மீதான பிற விளைவுகளாலும் அடக்கப்படலாம் - மைட்டோம்சின் சி அறிமுகம், புற ஊதா கதிர்வீச்சுடன் முன் சிகிச்சை அல்லது தொற்றுக்கு முன் செல் கருக்களை அகற்றுதல் (பாரி, 1964; ராட் மற்றும் பலர்., 1965; நாயக், ராஸ்முசென், 1966; ஃபோல்-லெட் மற்றும் பலர்., 1974; கெல்லி மற்றும் பலர்., 1974). இந்த விளைவுகள் இன்ஃப்ளூயன்ஸா வைரஸின் நகலெடுப்பை பாதிக்கும் வழிமுறையானது மற்ற நுண்ணுயிர் எதிர்ப்பிகளின் செயல்பாட்டின் பொறிமுறையைப் போலவே இருக்கலாம்.இந்த ஆய்வுகளில் இருந்து செய்யக்கூடிய ஒரே அனுமானம் என்னவென்றால், "செயல்பாட்டு" செயலில் உள்ள செல் கருக்கள் மற்றும் (அல்லது) இன்ஃப்ளூயன்ஸா வைரஸ்களின் பரவலுக்கான கலத்தின் டிஎன்ஏ சார்ந்த செயல்பாட்டில். இந்த செயல்பாடுகள் என்ன என்று சொல்ல முடியாது.
2. சைக்ளோஹெக்சிமைடு
விலங்கு உயிரணுக்களில் புரதத் தொகுப்பைத் தடுக்கும் சைக்ளோஹெக்சிமைடு, இன்ஃப்ளூயன்ஸா வைரஸால் பாதிக்கப்பட்ட 2 மணிநேரத்திற்குப் பிறகு சேர்க்கப்படும்போது, விஆர்என்ஏ உருவாக்கம் உடனடியாக நிறுத்தப்படும், அதே நேரத்தில் விஆர்என்ஏ உருவாக்கம் குறைந்தது 2 மணிநேரம் தொடர்கிறது (ஸ்கோல்டிசெக் மற்றும் ராட், 1970; போன்ஸ் , 1973). "விஆர்என்ஏவை ஒருங்கிணைக்கும் பாலிமரேஸிற்கான தரம்/கோஃபாக்டராகப் பயன்படுத்தப்படும் வைரஸ் அல்லது செல்லுலார் புரதத்தின் தொடர்ச்சியான தொகுப்பு தேவையா, அல்லது புதிதாக ஒருங்கிணைக்கப்பட்ட விஆர்என்ஏவை நிலைப்படுத்த சில "புரதங்கள் (எ.கா., என்பி புரதம்) தேவையா என்பது இன்னும் அறியப்படவில்லை. அல்லது ஒரு குறிப்பிட்ட வைரஸ் "புரதத்தின் தொகுப்பை அடக்குவது சிஆர்என்ஏவின் தொடர்ச்சியான உருவாக்கத்திற்கு வழிவகுக்கிறது, இதன் தொகுப்பு பொதுவாக நோய்த்தொற்றுக்கு 3 மணி நேரத்திற்குப் பிறகு அணைக்கப்படும். விஆர்என்ஏ தொகுப்பைத் தூண்டுவதற்கு இந்த பணிநிறுத்தம் அவசியமாக இருக்கலாம்.வெப்பநிலை உணர்திறன் மரபுபிறழ்ந்தவர்களின் ஆய்வுகள் இந்தக் கேள்விகளில் சிலவற்றிற்கு பதிலளிக்க வேண்டும்.
பீன் மற்றும் சிம்ப்சன் (1973) செய்த சோதனைகள், விவோவில் முதன்மை டிரான்ஸ்கிரிப்ஷன் (ஆர்என்ஏ டெம்ப்ளேட்டில் சிஆர்என்ஏவின் தொகுப்பு, தொற்று துகள் பாலிமரேஸைப் பயன்படுத்தி) சைக்ளோஹெக்ஸைமைடால் ஒடுக்கப்படவில்லை, அதே நேரத்தில் ஆக்டினோமைசின் டி டிரான்ஸ்கிரிப்ஷனை முழுவதுமாக அடக்குகிறது. எனவே, சைக்ளோஹெக்ஸைமைடு தொற்று துகள் மற்றும் சிஎஃப்ஆர்என்ஏவை ஒருங்கிணைக்கும் பாலிமரேஸின் செயல்பாட்டை விவோவில் பாதிக்காது; இருப்பினும், இது சிஎஃப்ஆர்என்ஏ உற்பத்திக்குத் தேவையான புதிய பாலிமரேஸின் தொகுப்பை அடக்குகிறது.
3. குளுக்கோசமைன்
குளுக்கோசமைன் UTP-]M-acetylglucosamine (Scholtissek, 1971) உருவாவதன் மூலம் குஞ்சு கரு உயிரணுக்களில் UTP குளத்தை குறைப்பதாக அறியப்படுகிறது. குளுக்கோஸ் கொண்ட ஏர்லின் கரைசல் ஒரு கலாச்சார ஊடகமாக பயன்படுத்தப்படும் போது, அது
வைரஸ் glncoproteins தொகுப்பில் மட்டுமே விளைவைக் கொண்டிருக்கிறது (பிரிவு V ஐப் பார்க்கவும்). எவ்வாறாயினும், ஆற்றல் மூலமாக குளுக்கோஸ் லைருவேட் அல்லது ஃபுகோஸால் மாற்றப்பட்டால், இந்த அமினோ சர்க்கரைகளால் UTP குளத்தின் குறைவு தோராயமாக 10 மடங்கு அதிகமாக நிகழ்கிறது. இந்த நிலைமைகளின் கீழ், புரவலன் கலத்தின் UTP பூல் விஆர்என்ஏ தொகுப்பின் விகிதத்தின் ஒரு குறிப்பிட்ட வரம்பாக மாறுகிறது, அதே சமயம் செல்லுலார் ஆர்என்ஏவின் தொகுப்பு இன்னும் பாதிக்கப்படவில்லை (ஸ்கோல்டிசெக், 1975) வைரஸ் ஆர்என்ஏ தொகுப்பை அடக்கியதன் விளைவாக, வைரஸ் புரதங்களின் உருவாக்கமும் இல்லை.
இந்தத் தரவை இரண்டு வழிகளில் விளக்கலாம்: செல்லுலார் டிஎன்ஏ-சார்ந்த மற்றும் ஆர்ஐசி பாலிமரேஸ்களுடன் ஒப்பிடும்போது வைரல் ஆர்என்ஏ-சார்ந்த ஆர்என்ஏ பாலிமரேஸ் யுடிபியுடன் குறைந்த தொடர்பைக் கொண்டுள்ளது அல்லது கலத்தில் யுடிபியின் இரண்டு அதிகமாகவோ அல்லது குறைவாகவோ சுயாதீனமான குளங்கள் உள்ளன. இது "வைரஸ் ஆர்என்ஏ தொகுப்புக்கு பயன்படுத்தப்படலாம் மற்றும் மற்ற குளுக்கோசமைனால் அதிகம் பாதிக்கப்படுகிறது, இது ஆர்என்ஏ பாலிமரேஸ்களால் அடி மூலக்கூறாகப் பயன்படுத்தப்படலாம்.
D. விட்ரோவில் உள்ள வைரல் ஆர்என்ஏவின் தொகுப்பு
இன்ஃப்ளூயன்ஸா வைரஸால் பாதிக்கப்பட்ட உயிரணுக்களில், பல ஆராய்ச்சியாளர்கள் ஆர்.என்.ஏ-சார்ந்த RNA பாலிமரேஸைக் கண்டுபிடித்தனர் (ஹோ, வால்டர்ஸ், 1966; ஸ்கொல்டிசெக், ரோட், 1969a; ஸ்கெஹெல், பர்க், 1969; ரக் மற்றும் பலர்., 1969; மஹி, ப்ரோம்லி, 1970; , 1973). பெரும்பாலான நொதிகளின் செயல்பாடு பாதிக்கப்பட்ட உயிரணுக்களின் மைக்ரோசோமல் பகுதியிலேயே காணப்பட்டது. இன் விட்ரோ அமைப்பில், இந்த செயல்பாடு RNase ஆல் அகற்றப்படுகிறது, ஆனால் DNAse மூலம் அல்ல. இதன் பொருள் உள் டெம்ப்ளேட் ஆர்என்ஏ- வினைக்கு நான்கு நியூக்ளியோசைட் டிரைபாஸ்பேட்டுகளின் இருப்பு தேவைப்படுகிறது மற்றும் ஆக்டின்-ஐசின் டிக்கு உணர்திறன் கொண்டது. இன் விட்ரோ வினையின் பெரும்பாலான உற்பத்தி குறைந்த சார்புடைய மூலக்கூறு எடையைக் கொண்டுள்ளது. Horisberger மற்றும் Guskey (1973) இன் தரவு சைட்டோபிளாஸில் இரண்டு வெவ்வேறு நொதி செயல்பாடுகள் இருப்பதாகக் கூறுகின்றன: ஒன்று Mg++-சார்ந்துள்ளது மற்றும் ஒப்பீட்டளவில் அதிக உப்பு செறிவுகளால் தடுக்கப்படுகிறது, மற்றொன்று Mn++-சார்ந்த மற்றும் அதிக உப்பு-எதிர்ப்பு. பிந்தைய நொதி செயல்பாடு வைரஸ் துகள் உள்ளேயும் காணப்படுகிறது (அத்தியாயம் 5 ஐப் பார்க்கவும்).
இன் விட்ரோ அமைப்பில் உள்ள சைட்டோபிளாஸ்மிக் என்சைம் தயாரிப்பு தொடர்பாக முரண்பட்ட முடிவுகள் பெறப்பட்டுள்ளன. ரக் ■ மற்றும் பலர். (1969) அவர்களின் கைகளில் இந்த நொதி குறைந்தபட்சம் சில விரியன் வகை ஆர்என்ஏக்களை (14 முதல் 19 எஸ் வரை) ஒருங்கிணைக்கிறது என்று அறிவித்தது. மைக்ரோசோமாலை அடைகாத்த பிறகு, இன் விட்ரோ அமைப்பில் தயாரிப்பின் அடிப்படை கலவையை நிர்ணயிக்கும் போது ஆசிரியர்கள் இந்த முடிவுக்கு வந்தனர். அறியப்பட்ட குறிப்பிட்ட கதிரியக்கத்தின் நான்கு-லேபிளிடப்பட்ட நியூக்ளியோசைட் ட்ரைபாஸ்பேட்டுகளுடனான பின்னம், இருப்பினும், அருகிலுள்ள ஆய்வின் தரவு
அடினிலிக் அமிலம் அண்டை நாடுகளுக்கு, [(a-32P]ATP) ஐப் பயன்படுத்தி அதே வேலையில் பெறப்பட்டது, Scholtissek (1969) மூலம் பெறப்பட்ட அருகிலுள்ள அண்டை ஆய்வுத் தரவுகளுடன் ஒத்துப்போகிறது, இதன் விளைவாக இன் விட்ரோ அமைப்பில் உள்ள தயாரிப்பு கட்டமைப்பைக் கொண்டுள்ளது என்ற முடிவுக்கு வந்தது. மஹி மற்றும் ப்ரோம்லி (1970) அவர்களின் அசல் வெளியீட்டில் சைட்டோபிளாஸ்மிக் என்சைம் மூலம் உற்பத்தி செய்யப்படும் இன் விட்ரோ அமைப்பில் உள்ள தயாரிப்பின் சில பகுதிகள் "விஆர்என்ஏ" ஆக இருக்க வேண்டும் என்று கூறியது. இருப்பினும், சமீபத்தில் ஹஸ்டி மற்றும் மஹி (1973) அருகில் உள்ள அண்டை ஆய்வுகளில் மற்றும் குறிப்பிட்ட கலப்பினமானது சைட்டோபிளாஸ்மிக் என்சைம் உருவாவதை உறுதிப்படுத்தியது, இது முதன்முதலில் ஸ்கொல்டிசெக் (1969) மூலம் காட்டப்பட்டது போல, சைட்டோபிளாஸ்மிக் என்சைம் உருவாவதை உறுதி செய்தது. 90% க்கும் குறைவான இன் விட்ரோ அமைப்பு hsRNA க்கு ஒரு அடிப்படை வரிசையை நிரப்புகிறது.Hastie and Mahy (1973) "ஆக்டினோமைசின் டி முன்னிலையில் அணுக்கரு நொதியால் ஒருங்கிணைக்கப்பட்ட இன் விட்ரோ அமைப்பில் கணிசமான சதவீத உற்பத்தியைக் கண்டறிந்தனர். பெயரிடப்படாத விஆர்என்ஏவைக் கொண்டு பைப்ரிடைஸ் செய்ய முடியவில்லை.எந்த ஆர்என்ஏ வகை அத்தகைய கலப்பினத்தைச் செய்ய இயலாது என்பது இன்னும் தெளிவாகத் தெரியவில்லை. இந்த நிலைமைகளின் கீழ் ஒருங்கிணைக்கப்பட்ட ஆர்என்ஏவின் மிகக் குறைந்த அளவே லேபிளிடப்படாத ஏஆர்என்ஏ (ஸ்கால்டிசெக், வெளியிடப்படாத தரவு) உடன் கலப்பினமாகிறது.
வைரல் ஆர்என்ஏவில் லேபிளிடப்பட்ட ஜிடிபியை இணைப்பதன் இயக்கவியல், இன் விட்ரோ அமைப்பில் ஆர்என்ஏ தொகுப்பின் மறுதொடக்கம் இல்லை என்பதைக் குறிக்கிறது. ஒரு கச்சா நொதி தயாரிப்பு குறைந்த உப்பு செறிவுகளில் அடைகாக்கப்பட்டால், கிட்டத்தட்ட அனைத்து புதிதாக ஒருங்கிணைக்கப்பட்ட RNA ஆரம்பத்தில் ஒற்றை இழையாக இருக்கும். இருப்பினும், பீனாலுடன் பிரித்தெடுக்கப்பட்ட பிறகு, "ஆர்என்ஏவின் பெரும்பகுதி ஆர்என்ஏஸ்-எதிர்ப்புத் தன்மை கொண்டது. பினோல், பாலிமரேஸ் மூலக்கூறால் நகலெடுக்கும் இடத்தில் ஒன்றாக இணைக்கப்பட்ட ஒற்றை-இழைப்பட்ட டெம்ப்ளேட் மற்றும் புதிதாக ஒருங்கிணைக்கப்பட்ட சிஆர்என்ஏ ஆகியவற்றைக் கொண்ட இடைநிலை நகலெடுக்கும் கட்டமைப்பை மாற்றுகிறது. பகுதியளவு இரட்டை இழை அமைப்பு (Feix et al., 1967; Oberg, Philipson, 1971). இன்ஃப்ளூயன்ஸா வைரஸ் நொதி தயாரிப்பு பற்றிய இந்தத் தரவு, இன் விட்ரோ அமைப்பில் உள்ள பாலிமரேஸ் பாலிமரைசேஷனைத் தொடங்குவது மற்றும் தொடர்வது மட்டுமல்லாமல், புதிதாக ஒருங்கிணைக்கப்பட்ட சங்கிலியை அதன் டெம்ப்ளேட்டிலிருந்து பிரிக்கிறது என்று பொருள்படலாம். இல்லையெனில், உயிரியல் செயல்பாடுகள் இல்லாத இரட்டை இழை கொண்ட RNA அமைப்பு உருவாகிறது (Paffenholz and Scholtissek, 1973) அதிக உப்பு செறிவு அல்லது சுத்திகரிக்கப்பட்ட நொதியுடன் அடைகாத்தல் மேற்கொள்ளப்பட்டால், உற்பத்தியின் பெரும்பகுதி ஏற்கனவே இரட்டை இழை கொண்ட RNA ஆகும். பீனால் பிரித்தெடுப்பதற்கு முன் (ஸ்க்வார்ட்ஸ், ஸ்கோல்டிசெக், 1973).
இன்ஃப்ளூயன்ஸா வைரஸ் ஆர்என்ஏ பாலிமரேஸின் இந்த குணம், இன் விட்ரோ அமைப்பில் பிரத்தியேகமாக cfRNA ஐ ஒருங்கிணைக்க பயன்படுத்தப்படுகிறது.
இன்ஃப்ளூயன்ஸா வைரஸின் வெவ்வேறு விகாரங்களின் மரபணு உறவை நிறுவ அழைக்கப்படுகிறது, அவற்றுக்கிடையேயான அடிப்படை வரிசையில் உள்ள ஹோமோலஜியை தீர்மானிப்பதன் மூலம் (Scholtissek, Rott, 1969b; Hobson, Scholtissek, 1970; Anschutz et al., 1972).
IV. வைரஸ் புரதங்களின் தொகுப்பு
விட்ரோ மொழிபெயர்ப்பில் ஏ
வைரஸ் புரோட்டீன்களின் தொகுப்புக்கு எந்த வகையான ஆர்.என்.ஏ-விர் அயனி அல்லது நிரப்பு-விவரமானது என்ற பிரச்சனை இன்னும் தீர்க்கப்படவில்லை.பாலிசோம்களுடன் தொடர்புடைய வைரஸ்-குறிப்பிட்ட ஆர்என்ஏ வகை தொடர்பாக முரண்பட்ட முடிவுகள் பெறப்பட்டுள்ளன.நாயக் (1970) கண்டுபிடித்தார். பாலிசோமால் பகுதியில் உள்ள சுக்ரோஸ் சாய்வு, முக்கியமாக vRNA, அதே சமயம் Pons (1972) பாலிசாவிலிருந்து பிரத்தியேகமாக vcRNA ஐ தனிமைப்படுத்தியது. பிந்தையது, ஆக்டினோமைசின் D ஐச் சேர்த்த பிறகு, இது vcRNA இன் தொகுப்பை முன்னுரிமையாக பாதிக்கும் என்பதைக் கவனிப்பதன் மூலம் உறுதிப்படுத்தப்பட்டது (பிரிவு III, B, பார்க்கவும், 1), தொற்றுக்கு 2 மணிநேரம் கழித்து, பாதிக்கப்பட்ட உயிரணுக்களின் பாலிசோம்களில் cfRNA கண்டறியப்படவில்லை (Pons, 1973).
E. coli மற்றும் இன்ஃப்ளூயன்ஸா வைரஸ் vRNA இலிருந்து ஒரு புரோட்டீன் தொகுப்பு முறையை ஒரு டெம்ப்ளேட்டாகப் பயன்படுத்தி, Siegert et al. (1973) விட்ரோவில் வைரஸ் NP புரதம் உருவாவதைக் கண்டறிந்தனர். இந்த பெயரிடப்பட்ட NP புரதமானது Ouchterlony சோதனையைப் பயன்படுத்தி ஜெல் மழையால் வகைப்படுத்தப்பட்டது. , கிங்ஸ்பரி மற்றும் வெப்ஸ்டர் (1973) முயல் ரெட்டிகுலோசைட்டுகளில் இருந்து பெறப்பட்ட புரோட்டீன் தொகுப்பு முறையைப் பயன்படுத்தி vRNA உடன் எந்த வைரஸ் புரதத் தொகுப்பையும் கவனிக்கவில்லை. இருப்பினும், அதே அமைப்பில், அவர்கள் ஒரு RNA மீது வைரஸ் M புரதத்தின் (ஓம். அத்தியாயம் 2) தொகுப்பைக் கண்டறிந்தனர். பாதிக்கப்பட்ட உயிரணுக்களிலிருந்து தனிமைப்படுத்தப்பட்ட டெம்ப்ளேட்.இதனால், விரியோபிக் மட்டும்தானா அல்லது நிரப்புப்பொருளா என்ற கேள்விக்கு பதிலளிக்க முடியாது, அல்லது ஒரு வகை ஆர்என்ஏ துண்டுகள் மற்றும் சில ஆர்என்ஏ துண்டுகள் மற்றொரு வகை புரத தொகுப்புக்கான டெம்ப்ளேட்களாக பயன்படுத்தப்படுகின்றன. பால்டிமோர் (1971) முன்மொழியப்பட்ட "எதிர்மறை" அல்லது "நேர்மறை" வைரஸ் சங்கிலியின் வரையறையைப் பயன்படுத்துவது இன்ஃப்ளூயன்ஸா வைரஸ்களுக்கு இப்போது கடினமாக உள்ளது.
பி. விவோவில் உள்ள வைரஸ் புரதங்களின் தொகுப்பு
வைரஸ் "புரதங்களின்" தொகுப்பு பற்றிய ஆய்வு, பாதிக்கப்பட்ட கலத்தில் செல் பாலிபெப்டைட்களின் தொகுப்பு வைரஸ்-குறிப்பிட்ட தொகுப்பு மூலம் மாற்றப்படுகிறது என்ற உண்மையால் எளிதாக்கப்படுகிறது. HPV (Joss et al., 1969; Skehel, 1972; Klenk, Rott, 1973), மற்றும் BHK 2IF உயிரணுக்களில் WSN இன்ஃப்ளூயன்ஸா வைரஸால் (Lasarowitz et al., 1971 வரை) பாதிக்கப்பட்ட கோழி கரு ஃபைப்ரோபிளாஸ்ட் செல்கள். தொற்று ஏற்பட்ட 4 மணி நேரத்திற்குப் பிறகு ஒருங்கிணைக்கப்படுகிறது
வைரஸ் புரதங்கள் மட்டுமே (31). சற்றே முன்னதாக, பாதிக்கப்பட்ட உண்ணிகளில் மூன்று அல்லது நான்கு பாலிபெப்டைட்களின் தொகுப்பை ஆராய்ச்சியாளர்கள் கவனித்தனர் (டெய்லர் மற்றும் பலர், 1969; ஜோஸ் மற்றும் பலர்., 1969; ஹாலண்ட், கீஹ்ன், 1970; வைட் மற்றும் பலர்., 1970). பின்னர், மற்ற பாலிபெப்டைடுகள் கண்டுபிடிக்கப்பட்டன (லாசோரோவிட்ஸ் மற்றும் பலர், 1971; ஸ்கெஹெல், 1972; க்ளெங்க் மற்றும் பலர்., 1972 பி; க்ரூக், எட்கிண்ட், 1973). பொதுவாக, அனைத்து கட்டமைப்பு β-புரதங்களும் பாதிக்கப்பட்ட உயிரணுக்களில் கண்டறியப்பட்டன: ஒன்று அல்லது இரண்டு பி-புரதங்கள், நியூக்ளியோகாபோயிட் சப்யூனிட் NP, சவ்வு புரதம் M, ஹீமாக்ளூட்டீனியம் கிளைகோபுரோட்டீன் பிளவுபடாத (HA) மற்றும் பிளவுபட்ட (HA1 மற்றும் HA2) வடிவங்களில், மற்றும் NA துணைக்குழு .
விரியன் புரதங்களுடன் கூடுதலாக, ஒன்று அல்லது இரண்டு கட்டமைப்பு அல்லாத புரதங்கள் (NS) விவரிக்கப்பட்டுள்ளன.
குறிப்பிடத்தக்க வேறுபாடுகள் உள்ளன<в уровнях синтеза отдельных вирусных полипептидов. NP- и NS-полипептиды обычно первыми обнаруживаются в зараженных «летках. Skehel (1973) предположил, что полипептиды Р2, NP и NS, которые первыми обнаруживаются в «клетках, зараженных ВЧП, являются
வைரஸ் மரபணுவின் மூன்று துண்டுகளின் விரியன் பாலிமரேஸ் மூலம் தேர்ந்தெடுக்கப்பட்ட டிரான்ஸ்கிரிப்ஷனின் போது உருவாக்கப்பட்ட ஆர்என்ஏ துண்டுகளின் தயாரிப்புகள். சைக்ளோஹெக்சிமைட்டின் முன்னிலையில் செல்கள் பாதிக்கப்பட்டு, நுண்ணுயிர் எதிர்ப்பியை அகற்றிய பின் துடிப்பு குறிச்சொல் சேர்க்கப்பட்டபோது, இந்த மூன்று பாலிபெப்டைடுகள் மட்டுமே கண்டறியப்பட்டன. இதன் அடிப்படையில், முதன்மைப் படியெடுத்தலின் போது அறிமுகப்படுத்தப்பட்ட விரியன் லோலிமரேஸின் உதவியுடன் இந்தக் கூறுகளுக்கான ஆர்என்ஏ மூலக்கூறுகள் உருவாக்கப்பட்டதாகக் கருதப்பட்டது. HPV உடன் சிக்கன் ஃபைப்ரோபிளாஸ்ட்களின் தொற்றுக்குப் பிறகு 4 முதல் 6 மணிநேரம் வரை, M-புரதத் தொகுப்பின் அளவு அதிகரிக்கிறது, மேலும் NS-லோலிலெப்டைடின் தொகுப்பு குறைகிறது (ஸ்கெஹெல், 1972, 1973). எனவே, அயோலிப்டைட் தொகுப்பின் அளவுகள் தனித்தனியாகக் கட்டுப்படுத்தப்படலாம் மற்றும் வளர்ச்சி சுழற்சியின் போது மாறுபடலாம்.
HA பாலிபெப்டைடை HA1 மற்றும் HA2 ஆக பிளவுபடுத்துவதைத் தவிர, பெரிய முன்னோடிகளின் பிளவுகளின் விளைவாக வைரஸ்-குறிப்பிட்ட இன்ஃப்ளூயன்ஸா வைரஸ் பாலிபெப்டைடுகள் பெறப்படுகின்றன என்பதற்கு எந்த ஆதாரமும் இல்லை (டெய்லர் மற்றும் பலர், 1969; லாசரோவிட்ஸ் மற்றும் பலர்., 1971, ஸ்கெஹெல் , 1972; Klenk, Rott, 1973 ).
ஆட்டோரேடியோகிராபி (பெக்ட், 1971) அல்லது செல் பின்னம் மற்றும் ஜெல் எலக்ட்ரோபோரேசிஸ் நுட்பங்களைப் பயன்படுத்தி பாதிக்கப்பட்ட உயிரணுக்களில் வைரஸ் கூறுகளை உள்ளூர்மயமாக்குவது தொடர்பான புதிய தகவல் சமீபத்தில் பெறப்பட்டது (டெய்லர் மற்றும் பலர், 1969, 1970). இந்த ஆய்வுகளின்படி, அனைத்து வைரஸ் புரதங்களின் தொகுப்பு சைட்டோபிளாஸில் நிகழ்கிறது. இம்யூனோஃப்ளோரெசன்ஸ் மூலம் நியூக்ளியோடைடு ஆன்டிஜெனின் உள்ளூர்மயமாக்கல் பற்றிய முந்தைய ஆய்வுகள், ஆன்டிஜெனை சைட்டோபிளாஸில் வெளியிடுவதன் மூலம் கருவில் தொகுப்பு ஏற்படுகிறது என்பதைக் குறிக்கிறது (லியு, 1955; ப்ரீடென்ஃபெல்ட் மற்றும் ஷாஃபர், 1957; ஹோல்டர்மேன் மற்றும் 960., 960). இருப்பினும், இம்யூனோஃப்ளோரசன்ஸ் ஆன்டிஜெனின் திரட்சியை தீர்மானிக்கிறது, அதன் தொகுப்பு அல்ல என்பது தெளிவாகிறது (பிரிவு IV, B, 2 ஐப் பார்க்கவும்).
1. ஆர்என்ஏ பாலிமரேஸ்
RNA-சார்ந்த RNA பாலிமரேஸின் வைரஸ்-குறிப்பிட்ட செயல்பாடு, இன்ஃப்ளூயன்ஸா வைரஸால் பாதிக்கப்பட்ட உயிரணுக்களில் நோய்த்தொற்றுக்குப் பிறகு 13 மற்றும் 3 மணிநேரங்களுக்கு இடையில் கண்டறியப்படலாம், இது பயன்படுத்தப்படும் செல் அமைப்பைப் பொறுத்து (Scholtissek and Rott, 1969a; Skehel and Burke, 1969; Ruck et al. அல்., 1969; மஹி, ப்ரோம்லி, 1970). தொற்றுக்குப் பிறகு கண்டறியக்கூடிய முதல் வைரஸ் சார்ந்த செயல்பாடு இதுவாகும். பெரும்பாலான வைரஸ் லோலிமரேஸ் செயல்பாடு மைக்ரோசோமல் பின்னத்தில் கண்டறியப்படுகிறது; இந்த செயல்பாட்டின் சில பகுதி கருக்களில் உள்ளது மற்றும் தீவிர கழுவுதல் மூலம் கூட அங்கிருந்து அகற்ற முடியாது. வெளிப்பாட்டின் இயக்கவியலில் அல்லது அணுக்கரு மற்றும் மைக்ரோசோமல் என்சைம்களுக்கு இடையே தேவையான இணை காரணிகளில் அடிப்படை வேறுபாடுகள் எதுவும் இல்லை (Scholtissek and Rott, 1969a; Mahy et al., 1975).
கலிகுரி மற்றும் டாம் (1970) முறையைப் பயன்படுத்தி ஒரு படிநிலையான சுக்ரோஸ் சாய்வில் சைட்டோபிளாஸத்தை மேலும் பிரித்தெடுத்தவுடன், பாலிமரேஸ் செயல்பாடு தோராயமான சவ்வுகளில் கண்டறியப்படுகிறது (கம்பன்ஸ் மற்றும் கலிகுரி, 1973; க்ளெங்க் மற்றும் பலர்., 1974a).
வைரஸ் பாலிமரேஸ் செயல்பாடு சுத்திகரிக்கப்பட்ட வைரஸ் துகள்களில் கண்டறியப்பட்டதால் (அத்தியாயம் 5 ஐப் பார்க்கவும்), இது எந்த வைரஸ் புரதங்களுடன் தொடர்புடையதாக இருக்கலாம் என்ற கேள்வி எழுகிறது, இன்ஃப்ளூயன்ஸா வைரஸால் பாதிக்கப்பட்ட உயிரணுக்களிலிருந்து தனிமைப்படுத்தப்பட்ட பாலிமரேஸ் சுமார் 200 மடங்கு சுத்திகரிக்கப்பட்டது. பாலிமரேஸ் செயல்பாட்டுடன் தொடர்புடைய ஒரே வைரஸ்-குறிப்பிட்ட தயாரிப்பு RNP ஆன்டிஜென் (NP புரதம் மற்றும் வைரஸ் vRNA, நிரப்பு நிர்ணய முறையால் தீர்மானிக்கப்படுகிறது). இந்த வளாகத்தில் இருந்து ஆர்என்ஏவை அகற்றுவதற்கான அனைத்து முயற்சிகளும் நொதியின் செயல்பாட்டின் முழுமையான இழப்புக்கு வழிவகுத்தன (ஸ்க்வார்ஸ் மற்றும் ஸ்கொல்டிசெக், 1973). பி புரதம் வைரஸ் பாலிமரேஸின் பங்கிற்கு ஒரு வேட்பாளராக முன்வைக்கப்பட்டது (கில்போர்ன் மற்றும் பலர்., 1972). அமினோ அமிலங்களுடன் விவோவில் பெயரிடப்பட்ட நொதி வளாகம், இன்ஃப்ளூயன்ஸா வைரஸால் பாதிக்கப்பட்ட உயிரணுக்களிலிருந்து தனிமைப்படுத்தப்பட்டு சுமார் 35 மடங்கு சுத்திகரிக்கப்பட்டபோது, எலக்ட்ரோஃபோரெடிக் பகுப்பாய்வு ஆரம்பத்தில் இந்த வளாகத்தில் ஹெச்பி-பெலோவாவை மட்டுமே வெளிப்படுத்தியது.< (Compans, Caliguiri, 1973). Впоследствии, однако, при других условиях введения;метки удалось обнаружить и Р-белок (Caliguiri, Compans, 1974). С другой стороны, Klenk и соавт. (1974) обнаружили Р-белок в цитоплазматическом золе, "который не обладает полимеразной активностью (Scholtissek, Rott, 1969a; Skehel, Burke, 1969). Эти наблюдения могут означать, что Р-белок осуществляет свою (Предполагаемую активность ферментов только при связывании с РНП-антигеном.
RNP ஆன்டிஜெனுக்கு எதிரான ஹைப்பர் இம்யூன் சீரம் பாலிமரேஸ் செயல்பாட்டைத் தடுக்காது என்பதால், RNP ஆன்டிஜெனுக்கு பாலிமரேஸ் செயல்பாடு இருப்பது சாத்தியமில்லை. இந்த குணமடையும் சீரம் (இன்ஃப்ளூயன்ஸா ஏ வைரஸால் பாதிக்கப்பட்ட விலங்குகளிடமிருந்து பெறப்பட்டது) ஆய்வு செய்யப்பட்ட அனைத்து இன்ஃப்ளூயன்ஸா ஏ வைரஸ் விகாரங்களின் பாலிமரேஸ் செயல்பாட்டைத் தடுக்கிறது, ஆனால் இன்ஃப்ளூயன்ஸா பி வைரஸின் பாலிமரேஸ் செயல்பாட்டைத் தடுக்கவில்லை. இந்த அவதானிப்புகள் அனைத்தும் ஆர்என்பி- ஆன்டிஜென் (BPHK + NP = புரதம்), cRNA-யின் தொகுப்புக்கான டெம்ப்ளேட்டாக செயல்படும்.
2. நியூக்ளியோகேப்சிட் புரதம்
NP புரதம் வைரஸ் RNA உடன் பிணைக்கப்பட்டு, RNP ஆன்டிஜெனை உருவாக்குகிறது. இது வைரியனில் இருந்து மட்டும் தனிமைப்படுத்தப்பட்ட NP புரதத்திற்கும் பொருந்தும், ஆனால் பாதிக்கப்பட்ட கலத்திலிருந்தும் (Schafer, 1957) "இதை முதல் முறையாக கண்டறிய முடியும். serological பொருள், எப்போது
நோய்த்தொற்றுக்கு சுமார் 3 மணிநேரத்திற்குப் பிறகு, ஹெமாக்ளூட்டினின் தோன்றுவதற்கு ஒரு மணி நேரத்திற்கு முன்பு (பிரீடன்ஃபெல்ட், ஷாஃபர், 1957). இந்த நேரத்திற்குப் பிறகு, RNP ஆன்டிஜென் டைட்டர் கணிசமாக அதிகரிக்காது. புதிய தொகுப்பு மற்றும் முதிர்ந்த துகள்களில் இணைத்தல் ஆகியவற்றுக்கு இடையேயான சமநிலை காரணமாக இது நிகழலாம். லேபிளிங் செய்வதன் மூலம், NP புரதம் “தொற்றுக்குப் பிறகு 2 மணி நேரத்திற்குள் பாதிக்கப்பட்ட உயிரணுக்களில் கண்டறியப்படலாம் (Scholtissek and Rott, 1961; Krug, 1972).
ஃப்ளோரசன்ட் ஆன்டிபாடிகளின் உதவியுடன், RNP ஆன்டிஜென் முதலில் கருக்களில் கண்டறியப்படுகிறது. பின்னர் அது சைட்டோபிளாஸில் தோன்றும் (பிரீடென்ஃபெல்ட் மற்றும் ஷாஃபர், 1957). கருக்கலைப்பு நோய்த்தொற்று (ஃபிராங்க்ளின், பிரிட்டன்ஃபீல்ட், 1959) போன்ற சில நிபந்தனைகளின் கீழ், பி-ஃப்ளூரோபெனிலாலனைன் (ஜிம்மர்மேன், ஷாஃபர், 1960) முன்னிலையில் அல்லது வான் மேக்னஸ் நிகழ்வின் நிலைமைகளின் கீழ் (ராட், ஸ்கோல்டிசெக், 1963), RNP -antigen கருக்களில் உள்ளது.
பாதிக்கப்பட்ட உயிரணுக்களின் கருக்களில் RNP ஆன்டிஜெனின் ஆரம்பக் குவிப்பு, NP புரதமும் அணுக்களுக்குள் ஒருங்கிணைக்கப்படுகிறது என்று அர்த்தமல்ல. ஆட்டோரேடியோகிராஃபிக் ஆய்வுகள், அத்துடன் செல் பிரித்தல் முறைகளின் பயன்பாடு, இது மற்றும் மற்றொரு அர்ஜினைன் நிறைந்த புரதத்தின் சைட்டோபிளாஸ்மிக் தொகுப்பு மற்றும் சைட்டோபிளாஸத்திலிருந்து கருக்களுக்கு அவற்றின் விரைவான போக்குவரத்து ஆகியவற்றைக் குறிக்கிறது (டெய்லர் மற்றும் பலர், 1969, 1970; பெக்ட், 1971).
பாதிக்கப்பட்ட உயிரணுக்களின் சாற்றில், RNP ஆன்டிஜெனின் ஒரு குறிப்பிட்ட பகுதி vRNA (Pons, 1971; Krug, 1972; Krug, Etkind, 1973) ஐக் கொண்டுள்ளது, இருப்பினும் வைரஸ் துகள்களில் ஒரே ஒரு வகை RNA மட்டுமே காணப்படுகிறது (இது எதுவுமில்லை vRNA இன் சுய-கலப்பினம்) (Scholtissek, Rott, 1971; Pons, 1971). வைரஸ் பரவல் செயல்பாட்டில் cfRNA கொண்ட RNP ஆன்டிஜென் ஒரு குறிப்பிட்ட பங்கைக் கொண்டிருக்கிறதா அல்லது செல்லுலார் பிரிவின் செயல்பாட்டின் போது தோன்றும் ஒரு கலைப்பொருளா என்பதை தீர்மானிக்க இயலாது. இரண்டு RNA இழைகளும் விட்ரோவில் உள்ள NP புரதத்துடன் சமமாக பிணைக்கப்படுகின்றன என்று காட்டப்பட்டது (Scholtissek and Becht, 1971). இவ்வாறு, ஏதேனும் இலவச NP புரதம் மற்றும் இலவச cRNA இருந்தால், ஒரே மாதிரியான செயல்பாட்டின் போது தொடர்புடைய RNP ஆன்டிஜென் உடனடியாக உருவாகிறது. விரியன் ஆர்என்ஏவை ஆர்என்பி ஆன்டிஜெனிலிருந்து பாலிவின் "இல்சல்பேட்" எம் (பான்ஸ் மற்றும் பலர், 1969) மூலம் இடமாற்றம் செய்யலாம். எனவே, RNP ஆன்டிஜெனில் வெவ்வேறு வைரஸ் ஆர்என்ஏக்களை மாற்றுவது செல்லுலார் ஹோமோஜெனேட்டுகளில் சாத்தியமா என்பதை சோதிக்க முடியும். 32P உடன் பல்வேறு காலகட்டங்களில் லேபிளிடப்பட்ட மற்றும் சைட்டோபிளாஸ்மிக் RNP ஆன்டிஜெனிலிருந்து தனிமைப்படுத்தப்பட்ட வைரஸ் ஆர்என்ஏவின் அடிப்படை கலவையில் ஏற்படும் மாற்றங்களிலிருந்து, க்ரூக் (1972) முடிவானது, சில cfRNA, RNP ஆன்டிஜெனுடன் இணைக்கப்படுவதற்கு முன்பு, இலவச வடிவத்தில் உள்ளது. NP- அணில் இருந்து. நியூக்ளியோசைட் ட்ரைபாஸ்பேட்டுகளின் x-நிலையில் (Scholtissek, 1965) லேபிளிடப்பட்ட பாஸ்பரஸை மெதுவாகச் சேர்ப்பதன் காரணமாக விலங்குகளின் வெசிகிள்களின் ஆர்என்ஏவில் 32P இன் ஒருங்கிணைப்பு குறிப்பிடத்தக்க பின்னடைவு கட்டத்தில் நிகழ்கிறது.
எந்த அடிப்படையும் உருவாக்கப்படவில்லை, க்ரூக் (1972) தரவு எச்சரிக்கையுடன் விளக்கப்பட வேண்டும்.
க்ரூக் (1972) மேற்கொண்ட "கருக்கள் மற்றும் சைட்டோபிளாஸில் RNP ஆன்டிஜெனின் தோற்றம்" பற்றிய இயக்கவியல் பகுப்பாய்வு, அணுக்கருக்களில் குவியும் RNP ஆன்டிஜென் சைட்டோபிளாஸில் காணப்படும் RNP ஆன்டிஜெனின் முன்னோடி அல்ல என்று கூறுகிறது.
3. கட்டமைப்பு அல்லாத புரதங்கள்
அறியப்படாத செயல்பாட்டின் பல கட்டமைப்பு அல்லாத வைரஸ்-குறிப்பிட்ட புரதங்கள் பாதிக்கப்பட்ட உயிரணுக்களுக்கு விவரிக்கப்பட்டுள்ளன. அவற்றில் ஒன்று, 25,000 மூலக்கூறு எடையுடன், பெரிய அளவில் குவிந்து, NS எனப் பெயரிடப்பட்டது. இரண்டு புரதங்களும், அவற்றின் பெப்டைட் வரைபடங்களில் உள்ள வேறுபாடுகளில் இருந்து பார்க்கப்படுவது போல, ஒன்றுக்கொன்று சார்பற்றவையாகத் தோன்றுகின்றன.பெரிய அளவு NS புரதம் கருக்களில் காணப்படுகின்றன (Lazarowitz et al., 1971; Krug, Etkind, 1973) இந்தத் தகவல் டிம்-மாக் (1969) இன் முந்தைய இம்யூனோஃப்ளோரெசென்ஸ் ஆய்வுகளின் தரவுகளுடன் ஒத்துப்போகிறது, அவர் "கட்டமைப்பு அல்லாத வைரஸ் ஆன்டிஜென்களுக்கு குறிப்பிட்ட ஆன்டிசெரம் கொண்ட கருக்களில் பிரகாசமான கறை படிவதைக் கண்டறிந்தார், மேலும் இந்த கறை NS புரதத்தின் இருப்பை பிரதிபலிக்கிறது. இந்த புரதமும் கண்டறியப்பட்டது. பாதிக்கப்பட்ட உயிரணுக்களிலிருந்து தனிமைப்படுத்தப்பட்ட இலவச மற்றும் சவ்வு-பிணைக்கப்பட்ட ரைபோசோம்களின் பின்னங்களில் முக்கிய வைரஸ்-குறிப்பிட்ட புரதமாக இருங்கள் (Pons, 1972; Compans, 1973; Klenk et al., 1974a). ரைபோசோம்களுடன் NS இன் தொடர்பு டோனல் விசையைச் சார்ந்ததாகத் தோன்றுகிறது (க்ரூக் மற்றும் எட்கைண்ட், 1973). குறைந்த அயனி வலிமை கொண்ட பஃபர்களில், இந்த நோலிபாப்டைடு இரண்டு ரைபோசோமால் துணைக்குழுக்களிலும் உறிஞ்சப்பட்டது, அதேசமயம் உப்பு சேர்த்தவுடன் அவற்றிலிருந்து அகற்றப்பட்டது.
ஒரு சமீபத்திய ஆய்வு (கிரிகோரியாட்ஸ், 1973) விரியன் பாலிபெப்டைட் M இலிருந்து வேறுபட்ட ஒரு கட்டமைப்பு அல்லாத பாலிபெப்டைட் என NS ஐ அடையாளம் காண்பதில் சில சந்தேகங்களை எழுப்பியுள்ளது. விரியனில் இருந்து M-பாலிபெப்டைடை அமில குளோரோஃபார்மெத்தனால் மற்றும் ஒரு புரதத்துடன் பிரித்தெடுக்க முடிந்தது. ஒரே மாதிரியான எலக்ட்ரோபோரேசிஸ் இயக்கம் முழு பாதிக்கப்பட்ட செல்கள், -நியூக்ளிகள் அல்லது பாலிசோம்களிலிருந்தும் பிரித்தெடுக்கப்படலாம்.எம் புரதத்தின் டிரிப்டிக் செயலாக்கத்தின் தயாரிப்புகளின் பகுப்பாய்வு, அத்துடன் அணு மற்றும் ரைபோசோம்-தொடர்புடைய புரதங்கள், பல போட்டிகளுக்கு வழிவகுத்தது, எம் மற்றும் NS புரதங்கள் ஒரே மாதிரியானவை. இருப்பினும், இந்த முடிவுகளுக்கு உறுதியான விளக்கத்தை வழங்க கூடுதல் தகவல்கள் தேவை.
NS ஐத் தவிர, மற்ற கட்டமைப்பு அல்லாத வைரஸ்-குறிப்பிட்ட கூறுகள் இருக்கலாம், இருப்பினும் அவை எதுவும் இல்லை. போதுமான அளவு வகைப்படுத்தப்படவில்லை. கட்டமைப்பு அல்லாத வைரஸ் ஆன்டிஜென்களுக்கு எதிராக இயக்கப்பட்ட ஆன்டிசெரத்தைப் பயன்படுத்துதல்,
Dimmock மற்றும் Watson (1969) பாதிக்கப்பட்ட உயிரணுக்களிலிருந்து கதிரியக்க முத்திரையிடப்பட்ட பாலிபெப்டைட்களை துரிதப்படுத்தினர். பாலிஅக்ரிலாமைடு ஜெல்லில் உள்ள எலக்ட்ரோஃபோரெடிக் பகுப்பாய்வு NS உடன் தொடர்புடைய முக்கிய கூறுகளுடன் பல கட்டமைப்பு அல்லாத பாலிபெப்டைடுகள் இருப்பதை பரிந்துரைத்தது. மீதமுள்ள கட்டமைப்பு அல்லாத கூறுகளில் ஒன்று மிக வேகமாக இடம்பெயர்கிறது மற்றும் Skehel (1972) மற்றும் Krug and Etkind (1973) விவரித்த 10,000 முதல் 15,000 வரையிலான மூலக்கூறு எடை கூறுகளுடன் ஒத்திருக்கலாம்.
4. சவ்வு எம் புரதம்
உறையின் லிப்பிட் பைலேயரின் உட்புற மேற்பரப்பைக் கோடுபடுத்தும் மற்றும் விரியன் நிறைந்திருக்கும் எம் புரதம், பாதிக்கப்பட்ட உயிரணுக்களில் ஒப்பீட்டளவில் சிறிய அளவில் காணப்படுகிறது. தொகுப்பு என்பது வைரஸ் இனப்பெருக்கத்தின் விகித-கட்டுப்படுத்தும் கட்டமாகும் (லாசரோவிட்ஸ் மற்றும் பலர், 1971) இந்த கருத்து 29 ° C வெப்பநிலையில், வைரஸ் உற்பத்தி ஒடுக்கப்படும் போது, M புரதம் மட்டுமே வைரஸ்-குறிப்பிட்ட தரவுகளால் ஆதரிக்கப்படுகிறது. பாதிக்கப்பட்ட உயிரணுக்களில் கண்டறிய முடியாத புரதம் (Klenk, Rott, 1973).
M புரதம் (பாதிக்கப்பட்ட உயிரணுக்களின் மென்மையான மற்றும் பிளாஸ்மா சவ்வுகளில் காணப்படுகிறது (லாசரோவிட்ஸ் மற்றும் பலர், 1971; கார்ன்பான்ஸ், 1973a; க்ளெங்க் மற்றும் பலர்., 1974a). இந்தத் தரவு சவ்வுகளுக்கு இந்த புரதத்தின் தொடர்பைக் குறிக்கிறது.
5. ஹேமக்ளூட்டினின்
ஹெமாக்ளூட்டினின் ஒரு பெரிய கிளைகோபுரோட்டீனாக ஒருங்கிணைக்கப்படுகிறது - HA இன் முன்னோடி, இது பின்னர் இரண்டு சிறிய கிளைகோபுரோட்டீன்களாகப் பிரிக்கப்படுகிறது: HAi மற்றும் HA2 "(Lazarowitz et al., 1971). பிளவு, இது புரோட்டீஸ், 3, க்லென்க்பிட் மூலம் ஒடுக்கப்படலாம் ), புரவலன் கலத்தின் புரோட்டியோலிடிக் என்சைம்களால் வெளிப்படையாக மேற்கொள்ளப்படுகிறது (லாசரோவிட்ஸ் மற்றும் பலர், 1973) பிளவு பட்டம் வைரஸின் திரிபு, ஹோஸ்ட் செல், சைட்டோடாக்ஸிக் விளைவு நிலை மற்றும் இருப்பு அல்லது இல்லாமை ஆகியவற்றைப் பொறுத்தது. மீடியத்தில் சீரம் (Lazarowitz et al., 1971, 1973a, b சீரம் இல்லாத நிலையில் MDBK செல்களில் WSN virions வளர்க்கப்பட்டால், பிளவு கிட்டத்தட்ட இல்லாமல் இருக்கும்.இருப்பினும், சீரம் இருந்தால், WSN ஹேமக்ளூட்டினினும் பிளவுபடும்.இதில் பிளவு
அமைப்பு பிளாஸ்மா சவ்வு மீது நடைபெறுகிறது (Lazaro-witz et al., 1973a). VChP அமைப்பில், அத்தகைய பிளவுகளின் வழிமுறை வெளிப்படையாக வேறுபட்டது. பிளவு "செல்லுலார் சவ்வுகளில் நிகழ்கிறது, மேலும் இந்த விஷயத்தில் பிளாஸ்மினோஜென் தேவையில்லை (Shchepk et al., 1974a). பிளவு பட்டம் 25 °C இல் கூர்மையாக குறைகிறது (Klenk and Rott, 1973).
ஹெமாக்ளூட்டினேட்டிங் செயல்பாடு அல்லது விரியன் அசெம்பிளிக்கு HA பிளவு தேவை இல்லை (La-zarowitz et al., 1973a; Stanley et al., 1973), ஆனால் சமீபத்திய ஆய்வுகள் இது தொற்றுநோய்க்கு அவசியம் என்று கண்டறிந்துள்ளது (Klenk et al., 1975b). இந்த தரவு உறிஞ்சுதலில் அதன் பங்கிற்கு கூடுதலாக, தொற்று செயல்பாட்டில் HA* மற்றொரு செயல்பாட்டைக் கொண்டுள்ளது மற்றும் இந்தச் செயல்பாட்டிற்கு சிதைவு அவசியம். , மற்றும் பிளவுபடாத HA கொண்ட துகள்கள் குறைவான தொற்றுத்தன்மை கொண்டவை, இன்ஃப்ளூயன்ஸா வைரஸ் நோய்த்தொற்றின் புரவலன் வரம்பு மற்றும் பரவல் ஒரு ஹோஸ்ட் செல் புரோட்டீஸ் ஒரு செயல்படுத்தும் நொதியாக இருப்பதைப் பொறுத்தது என்று கூறுகின்றன.
"Vi நோயால் பாதிக்கப்பட்ட லெட்ஸின் பின்னம் பற்றிய சோதனைகளில்
ரஸ் இன்ஃப்ளூயன்ஸா, HA கிளைகோபுரோட்டின்கள் எப்போதும் இருப்பது கண்டறியப்பட்டது
சவ்வுகளுடன் தொடர்புடையவை (காம்பன்ஸ், 1973a; க்ளெங்க் மற்றும் பலர்.,.
1974a). இந்த புரதங்கள் மற்றும் அவற்றின் தருணங்களின் உள்-செல்லுலார் உள்ளூர்மயமாக்கல்
கரடுமுரடான சவ்வுகளிலிருந்து மென்மையான எண்டோபிளாஸ்மிக் சவ்வுகள் வரை வாக்கி-டாக்கி
ஸ்கை ரெட்டிகுலம் மற்றும் பிளாஸ்மா சவ்வுகளுக்கு டி இருக்கும்
பிரிவு VII, B இல் விரிவாக விவரிக்கப்பட்டுள்ளது. .,
6. நியூராமினிடேஸ்
செயலில் உள்ள நொதியாக வைரஸ் NA* கண்டுபிடிக்கப்பட்டது
கோரியானிக் அலன்டோயிக் மென்படலத்தில் தொற்று ஏற்பட்டு 3 மணி நேரம் கழித்து
இல்லை, மற்றும் எக்ஸ்ட்ராபோலேஷன் மூலம் அதன் ஒத்திசைவின் ஆரம்பம் என்று நிறுவப்பட்டது
நோய்த்தொற்று ஏற்பட்ட 1-2 மணி நேரத்திற்குப் பிறகு ஆய்வறிக்கை நிகழ்கிறது (நோல் மற்றும் பலர்.,
1961). NA* இன் உள்செல்லுலார் உள்ளூர்மயமாக்கல் பயன்படுத்தி ஆய்வு செய்யப்பட்டது
பின்னர் செல் பின்னம், மற்றும் அவள் வெளிப்படையாக கண்டுபிடிக்கப்பட்டது
mu, HA* இன் உள்ளூர்மயமாக்கலைப் போன்றது (Compans, 1973a; Klenk et al.,
1974a). NA* சவ்வுகளுடன் இணைந்து கண்டறியப்பட்டது,
மென்மையான எண்டோபிளாஸ்மிக் ரெட்டிகுலத்திலிருந்து பெறப்பட்டது,
உயிரியல் செயல்பாடு மற்றும் பகுப்பாய்வு மூலம் அதை தீர்மானிக்கும் போது
பாலியாழ்ரிலமைடு ஜெல்லில் zu. என்சைம் செயல்பாடு அதிகமாக இருந்தது
தேனா கரடுமுரடான சவ்வுகளைக் கொண்ட பின்னங்களிலும் உள்ளது
எங்களுக்கு. இந்தத் தரவுகள் பெறப்பட்ட தரவுகளுடன் ஒத்துப்போகின்றன
இம்யூனோஃப்ளோரசன்ஸ் (மேனோ, கில்போர்ன், 1970). 4 மணி நேரம் கழித்து
தொற்றுக்குப் பிறகு, சைட்டோபிளாஸில் நியூராமினிடேஸைக் கண்டறியலாம்
பிளாஸ்மா; பின்னர் அவள் பெரியில் கவனம் செலுத்துகிறாள்
செல் ஃபெரியா.
வி. கார்போஹைட்ரேட்டுகளின் தொகுப்பு
கார்போஹைட்ரேட்டுகள் இன்ஃப்ளூயன்ஸா வைரஸ் உறையின் கிளைகோபுரோட்டின்கள் மற்றும் கிளைகோலைடுகளை உருவாக்குவதில் ஈடுபட்டுள்ளன (க்ளெங்க் மற்றும் பலர், 1972a). மைக்ஸோவைரஸின் கிளைகோலிப்பிட்கள் (புரவலன் கலத்தின் பிளாஸ்மா சவ்வுகளிலிருந்து (க்ளென்க், சோப்பின், 1970) தோற்றம் பெற்றது, ஆனால் இது முக்கியமாக வைரியனில் சேர்க்கப்பட்டுள்ளது: முன்பே இருக்கும் அல்லது புதிதாக ஒருங்கிணைக்கப்பட்ட கிளைகோலிப்பிடுகள்.
குறிப்பாக வைரஸ் குளுக்கோபெல்டைடுகளில் இணைக்கப்பட்டுள்ள குளுக்கோசமைன், மன்னோஸ், கேலக்டோஸ் மற்றும் ஃபுகோஸ் போன்ற கதிரியக்க முன்னோடிகளின் பயன்பாடு, இந்த கிளைகோபெப்டைட்களின் கார்போஹைட்ரேட் பக்க சங்கிலிகள் நோய்த்தொற்றின் போது மீண்டும் ஒருங்கிணைக்கப்படுகின்றன என்பதைக் காட்டுகிறது (ஹஸ்லாம் மற்றும் பலர்., 1970; கார்ன்பான்ஸ். 1970a; ஸ்வார்ஸ் மற்றும் க்ளெங்க், 1974). செல் பின்னம் சோதனைகள் வைரஸ் கிளைகோபுரோட்டீன்களின் கிளைகோசைலேஷன் தளங்கள் பற்றிய கூடுதல் தகவலை வழங்கியுள்ளன.குளுக்கோசமைன் மென்மையான மற்றும் கடினமான சைட்டோபிளாஸ்மிக் சவ்வு பின்னங்களில் HA பாலிபெப்டைடுடன் தொடர்புடையது; இருப்பினும், ஃபியூகோஸ் மென்மையான ஆனால் கடினமான சவ்வுகளில் HA உடன் தொடர்புடையது (காம்பன்ஸ், 1973b). .புரோமைசின் மூலம் புரோட்டீன் தொகுப்பை அடக்குவது குளுக்கோசமைனின் ஒருங்கிணைப்பை உடனடியாக நிறுத்துகிறது, அதே சமயம் ஃபுகோஸ் சுமார் 10-15 நிமிடங்களுக்கு (ஸ்டான்லி மற்றும் பலர்., 1973) தொடர்ந்து இணைக்கப்படுகிறது. இறுதியாக, FPV இல், கிளைகோபுரோட்டீன் HA மற்றும் HA இன் முன்னோடியாகும். ஹஜ் தயாரிப்புகள்<и НА2 содержат, по-видимому, полный состав маннозы « глюкозамина, тогда как содержание фукозы и галактозы значительно выше в продуктах расщепления (Klenk et al., 1975a; Schwarz, Klenk, 1974). Эта наблюдения предполагают, что биосинтез углеводных боковых целей гликопротеинов НА осуществляется по стадиям с различными остатками Сахаров, добавляемыми в разных участках клетки. Глюкозамин и манноза (присоединяются, по-видимому, к полипептидам НА на шероховатых мембранах вскоре после или даже в процессе синтеза поляпептида, в то время как фукоза, вероятно, прикрепляется позже с помощью трансфераз, присутствующих в гладких мембранах.
இந்த கிளைகோசைல்ட்ரான்ஸ்ஃபெரேஸ்கள் செல்லுலார் என்சைம்களாக இருக்கலாம். இதன் விளைவாக, கார்போஹைட்ரேட் (கிளைகோபுரோட்டீன்களின் ஒரு பகுதியானது ஹோஸ்ட் செல் மூலம் வெளிப்படையாகத் தீர்மானிக்கப்படுகிறது. இருப்பினும், இந்த ஹோஸ்ட் செல் என்சைம்களுக்கு கூடுதலாக, வைரஸ் NA* கார்போஹைட்ரேட் பக்கச் சங்கிலிகளை உருவாக்குவதில் குறிப்பிடத்தக்க பங்கு வகிக்கிறது என்பதற்கான சான்றுகள் உள்ளன. மைசியோவைரஸின் ஓடுகளின் மேற்பரப்பில் நியூராமினிக் அமிலம் இல்லை என்று நிறுவப்பட்டது (க்ளெங்க், சோப்பின், 1970 பி; க்ளெங்க் மற்றும் பலர்., 1970), அதே நேரத்தில் இந்த நொதியைக் கொண்டிருக்காத வைரஸ் ஓடுகளில், அத்தகைய கார்போஹைட்ரேட் ஒரு பொதுவான அங்கமாகும் (க்ளெங்க், சோப்பின், 1971 ; McSharry, Wagner, 1971 ; Renkonen et al., 1971) இந்தத் தகவல்கள் தெரிவிக்கின்றன
நியூராமினிக் அமிலத்தின் விளைவு myxoviruses இன் இன்றியமையாத அம்சமாகும். இன்ஃப்ளூயன்ஸா வைரஸ் உறையில் இருந்து நியூராமினிக் அமிலத்தை அகற்றுவதற்கு NA* பொறுப்பு என்று சமீபத்தில் காட்டப்பட்டது, இதனால் வைரஸ் உறை மீது ஏற்பிகள் உருவாவதைத் தடுக்கிறது, இல்லையெனில் பெரிய அளவிலான வைரஸ் துகள்கள் உருவாக வழிவகுக்கும் (பாலீஸ் மற்றும் பலர்., 1974) NA* இன் கார்போஹைட்ரேட் பகுதி, முக்கிய மேற்பரப்பு கிளைகோபுரோட்டீனாக, (செல்லுலார் டிரான்ஸ்ஃபெரேஸ்கள் மற்றும் வைரஸ் NA*) ஆகியவற்றின் ஒருங்கிணைந்த செயல்பாட்டின் விளைவாகும் என்ற கருத்தை இந்தத் தரவு ஆதரிக்கிறது. அதன் செயலுக்கு நன்றி, வைரஸ் ஒரு வைரஸை அறிமுகப்படுத்த முடியும்- குறிப்பிட்ட மாற்றம் (ஆரம்பத்தில், கார்போஹைட்ரேட் மாற்றத்தின் ஒரு புரவலன்-குறிப்பிட்ட, சிக்கலான அமைப்பு, இதன் படி - வைரஸின் உயிரியல் செயல்பாட்டிற்கு வெளிப்படையாக அவசியம்.
டி-குளுக்கோசமைன் மற்றும் 2-டியோக்சி-ஓ-குளுக்கோஸ் உயிரியல் ரீதியாக செயல்படும் HA*, NA* மற்றும் தொற்று வைரஸ் (Kilbourne, 1959; Kaluza et al., 1972) உருவாவதைத் தடுக்கிறது. உயிர்வேதியியல் ஆய்வுகள் இந்த சர்க்கரைகள் வைரஸ் கிளைகோபுரோட்டீன்களின் உயிரியக்கத்துடன் போட்டியிடுகின்றன என்பதை வெளிப்படுத்தியுள்ளன (காந்தி மற்றும் பலர், 1972; க்ளெங்க் மற்றும் பலர்., 1972b). இந்த தடுப்பான்களின் முன்னிலையில், கிளைகோபுரோட்டீன் NA அளவு குறைகிறது.குறைப்பின் அளவு அளவைப் பொறுத்தது.இதனால், சர்க்கரையின் செறிவு அதிகரிப்புடன், 76,000 மூலக்கூறு எடை கொண்ட கிளைகோபுரோட்டீன் NA படிப்படியாக ஒரு கலவையாக மாறுகிறது. மூலக்கூறு எடை 64,000, இது HA0 (கிளென்க் மற்றும் பலர், 1972b; ஸ்வார்ஸ் மற்றும் க்ளெங்க், 1974) என குறிப்பிடப்பட்டது. மூலக்கூறு எடையில் மாற்றம் கார்போஹைட்ரேட் உள்ளடக்கம் குறைவதற்கு இணையாக உள்ளது மற்றும் HA0 புரதம் கார்போஹைட்ரேட்டுகள் இல்லாமல் இருப்பது கண்டறியப்பட்டது (ஸ்க்வார்ஸ்ஸ் மற்றும் க்ளென்க், 1974).இந்த முடிவுகள் HA0 என்பது HA கிளைகோபுரோட்டின் முழுமையடையாத கிளைகோசைலேட்டட் அல்லது "எக்லைகோசைலேட்டட் பாலிபெப்டைட் சங்கிலி மற்றும் டி-குளுக்கோஸ் அமீன் a மற்றும் 2-டியோக்ஸி-ஓ-குளுக்கோஸின் தடுப்பு விளைவு கிளைகோசி சேதத்தால் ஏற்படுகிறது. HA0 பாலிபெப்டைடு சவ்வுகளுடன் தொடர்புடையது, சாதாரண HA போல இதுவும் கரடுமுரடான நிலையில் இருந்து மென்மையான ரெட்டிகுலத்திற்கு இடம்பெயர்கிறது, அங்கு அது பாலிபெப்டைடுகள் HA01 மற்றும் HA02 ஆக பிளவுபடுகிறது. எனவே, சவ்வுக்கான இந்த பாலிபெப்டைட்டின் தொடர்புக்கு கார்போஹைட்ரேட்டுகள் அவசியமில்லை. இருப்பினும், பாதிக்கப்பட்ட உயிரணுக்களில் ஹீமாக்ளூட்டினேட்டிங் செயல்பாடு இல்லாதது கிளைகோசைலேட்டட் அல்லாத புரதம் ஏற்பிகளுடன் பிணைக்க முடியாது என்று கூறுகிறது.
VI. லிப்பிட் தொகுப்பு
அனைத்து உறைந்த வைரஸ்களைப் போலவே, இன்ஃப்ளூயன்ஸா வைரஸும் ஹோஸ்ட் செல் லிப்பிட்களை மறுசுழற்சி செய்வதன் மூலம் அதன் லிப்பிட்களைப் பெறுகிறது. இந்த நிலை பின்வரும் அவதானிப்புகளால் உறுதிப்படுத்தப்பட்டுள்ளது:
டெனியா. இன்ஃப்ளூயன்ஸா வைரஸின் லிப்பிட் கலவை புரவலன் உயிரணுவைப் போலவே இருப்பது கண்டறியப்பட்டது (ஆம்ப்ரஸ்டர் மற்றும் பீஸ், 1958; ஃப்ரோம்ஹேகன் மற்றும் பலர்., 1959). புரவலன் செல் லிப்பிடுகள், நோய்த்தொற்றுக்கு முன் கதிரியக்கமாக பெயரிடப்பட்டவை, வைரஸ் துகள்களில் இணைக்கப்படுகின்றன (வெக்கர், 1957). வைரஸ் பல்வேறு புரவலன் செல்களில் வளரும் போது, வைரஸ் லிப்பிட்களின் மாற்றங்கள் கண்டறியப்படுகின்றன (கேட்ஸ் மற்றும் பலர், 1961, 1962). பொதுவாக, வைரஸ்களின் லிப்பிடுகள் (செல் மேற்பரப்பில் இருந்து மொட்டு, புரவலன் செல்லின் பிளாஸ்மா சவ்வின் கொழுப்பு கலவையை நெருக்கமாக பிரதிபலிக்கிறது (க்ளென்க், சோப்பின், 1969; 1970a, b; ரென்கோ-னென் மற்றும் பலர்., 1971). இன்ஃப்ளூயன்ஸா வைரஸ் தொற்றுக்குப் பிறகு 7 மணி நேரம் வரை குஞ்சுக் கரு ஃபைப்ரோபிளாஸ்ட் உயிரணுக்களில் உள்ள டி நோவோ தொகுப்பு ஃபோஸ்போலிலைடுகளின் அளவு மாறாமல் இருந்தது, அதன் பிறகு அனைத்து கொழுப்புத் தொகுப்புகளும் அடக்கப்பட்டன. ஆர்.என்.ஏ அல்லது புரதத் தொகுப்பைத் தடுப்பது அல்லது "பிற உயிரியல் விளைவுகளுடன் தொடர்புடையது."
எனவே, இன்றுவரை பெறப்பட்ட முடிவுகளின் அடிப்படையில், சாதாரண செல்லுலார் லிப்பிட் உயிரியக்க செயல்முறைகள் மூலம் வைரஸ் லிப்பிட்களின் தொகுப்பு நிகழ்கிறது என்று கருதலாம், மேலும் புரவலன் கலத்தின் பிளாஸ்மா மென்படலத்திலிருந்து லிப்பிட்களை இணைப்பதன் மூலம் வைரஸ் உறை உருவாகிறது.
VII. அசெம்பிளி (அத்தியாயம் 2 ஐயும் பார்க்கவும்)
A. நியூக்ளியோகாப்சிட்களின் உருவாக்கம்
ஏற்கனவே குறிப்பிட்டுள்ளபடி, நியூக்ளியோகாப்சிட் புரதம் சைட்டோபிளாஸில் ஒருங்கிணைக்கப்படுவது பெரும்பாலும் உள்ளது. வெளிப்படையாக, அது ஒரு குறுகிய காலத்திற்கு இலவச வடிவத்தில் உள்ளது, பின்னர் வைரஸ் ஆர்என்ஏவுடன் இணைந்து, நியூக்ளியோகாப்சிட்களை உருவாக்குகிறது (க்ளென்க் மற்றும் பலர், 1974; கம்பன்ஸ் மற்றும் கலிகுரி, 1973). NP புரதம் யாக்ளியோகாப்சிட்களில் விரைவாக இணைக்கப்படுவதால், சீர்திருத்தப்பட்ட குளத்தில் இருந்து RNA தேர்ந்தெடுக்கப்படலாம் (Krug, 1972). இன்ஃப்ளூயன்ஸா வைரஸ் நியூக்ளியோகேப்சிட்களின் சிறிய அளவு காரணமாக, எலக்ட்ரான் நுண்ணோக்கியைப் பயன்படுத்தி பாதிக்கப்பட்ட உயிரணுக்களில் அவற்றைத் துல்லியமாக அடையாளம் காண முடியாது. சைட்டோபிளாஸில் காணப்பட்ட சுமார் 5 nm விட்டம் கொண்ட இழைகள் அல்லது இழைகளின் கொத்துகள் வைரஸ் ரிபோநியூக்ளியோபுரோட்டீன்களைக் குறிக்கலாம் (அபோஸ்டோலோவ் மற்றும் பலர், 1970; கம்பன்ஸ் மற்றும் பலர்., 1970b).
இன்ஃப்ளூயன்ஸா வைரஸ் விரியன்களின் ஆர்என்ஏ மரபணு 5-7 துண்டுகளைக் கொண்டுள்ளது என்று கிடைக்கக்கூடிய தரவு குறிப்பிடுகிறது (அத்தியாயம் 6 ஐப் பார்க்கவும்).
எனவே, எந்தவொரு தொற்று துகளுக்கும் ஒவ்வொரு துண்டின் குறைந்தது ஒரு நகல் தேவை. ஹிர்ஸ்ட் (1962) முன்-
உள்செல்லுலார் குளத்திலிருந்து நியூக்ளியோகாப்சிட்கள் சேர்க்கப்படலாம் என்று கூறப்பட்டது (விரியன்கள் சீரற்ற முறையில். E மக்கள்தொகையில் தொற்று வைரான்களின் விகிதத்தை சராசரி விரியனில் கூடுதல் ஆர்என்ஏ துண்டுகளைச் சேர்ப்பதன் மூலம் அதிகரிக்கலாம் (கம்பன்ஸ் மற்றும் பலர், 1970). எடுத்துக்காட்டாக, ஐந்து தொற்று பல்வேறு ஆர்.என்.ஏ துண்டுகளுக்குத் தேவை, ஒவ்வொரு விர்னோயிலும் மொத்தம் 7 துண்டுகள் வீர்னோயில் தோராயமாக சேர்க்கப்பட்டுள்ளது, பின்னர் தோராயமாக 22% வைரான்கள் தொற்றுநோயாக இருக்க வேண்டும். ஆர்.என்.ஏ துண்டுகள் சீரற்ற முறையில் சேர்க்கப்பட்டதற்கான சான்றுகள் ஹிர்ஸ்டின் சமீபத்திய அவதானிப்புகளால் வலுப்படுத்தப்பட்டது ( 1973) வைரஸ் மக்கள்தொகையில், பிளேக்குகளை உருவாக்காத துகள்களுக்கு இடையில் மீண்டும் ஒருங்கிணைவு ஏற்படுகிறது. அத்தகைய துகள்களின் மறுசேர்க்கையில் பங்கேற்கும் திறனை, துகள்களில் ஒன்று அல்லது அதற்கு மேற்பட்ட துண்டுகள் இல்லாததால், காணாமல் போன துண்டுகள் ஒரு துகளிலிருந்து மாறுபடும். மற்றொன்றுக்கு, அதனால் குறைபாடுள்ள வைரஸின் பொருத்தமான துகள்கள் மறுசீரமைப்புகளை உருவாக்கலாம்.
பி. வைரஸ் பிணைப்பு செயல்முறை
மூடியிருக்கும் பெரும்பாலான வைரஸ்களைப் போலவே, இன்ஃப்ளூயன்ஸா வைரஸும் முன்பே உருவாக்கப்பட்ட செல் சவ்வுகளில் கூடுகிறது; பிளாஸ்மா மென்படலத்திலிருந்து துளிர்ப்பதன் மூலம் அசெம்பிளி ஏற்படுகிறது. இன்ஃப்ளூயன்ஸா வைரஸால் பாதிக்கப்பட்ட உயிரணுக்களின் ஆரம்பகால எலக்ட்ரான் நுண்ணோக்கி ஆய்வுகளில் மர்பி மற்றும் பேங் (1952) ஆகியோரால் சிதைவு ஏற்படாத செயல்முறையின் மூலம் உயிரணுவிலிருந்து வைரஸ் வெளியிடப்பட்டது. தொற்று வைரஸ் உருவாகும் போது உயிரணுக்களுக்குள் வைரஸ் துகள்கள் தெரியவில்லை, எனவே செல் மேற்பரப்பில் வைரஸ் துகள்கள் உருவாகின்றன என்பது தெளிவாகத் தெரிந்தது.ஃபெரிடின்-லேபிளிடப்பட்ட ஆன்டிபாடிகளைப் பயன்படுத்தி, மார்கன் மற்றும் பலர் (1961) செல் மேற்பரப்பில் வைரஸ் இருப்பதைக் கண்டறிந்தனர். வைரஸ் உருவாகும் பகுதிகளில் உள்ள ஆன்டிஜென்.பின்னர் எலக்ட்ரான் நுண்ணோக்கி ஆய்வுகள், வளரும் வைரஸின் மேற்பரப்பில் வெளிப்புற மேற்பரப்பில் உள்ள வைரஸ் "ஸ்பைக்"களுடன் தொடர்புடைய கணிப்புகளின் அடுக்குடன் ஹோஸ்ட் செல் போன்ற அதே சவ்வு இருப்பதைக் காட்டியது. வைரஸ் சவ்வின் மேற்பரப்பில் செல் மேற்பரப்பில் இல்லாத கூடுதல் எலக்ட்ரான்-அடர்த்தியான அடுக்கு உள்ளது, இது அநேகமாக எம்-ஒலிபெப்டைட்களைக் கொண்டுள்ளது (பாச்சி மற்றும் பலர், 1969; கம்பன்ஸ், டிம்மாக், 1969; அப்போஸ்டோலோவ் மற்றும் பலர்., 1970).
எலக்ட்ரான் நுண்ணோக்கி ஆய்வுகள் ■ வைரஸ் கூறுகளின் வரிசையை பரிந்துரைப்பதற்கான அடிப்படையை வழங்கியுள்ளன-
செல் சவ்வு மீது இணை (Bachi et al., 1961; Compans and Dimmock, 1969; Compans et al., 1970b).
வைரஸ் உறை புரதங்கள் முதலில் தோன்றும், அவை சாதாரண உருவ அமைப்பைக் கொண்டிருக்க வேண்டிய மென்படலத்தின் சில பகுதிகளில் சேர்க்கப்படுகின்றன; இருப்பினும், மென்படலத்தின் இந்தப் பகுதிகளில் எரித்ரோசைட்டுகளின் குறிப்பிட்ட உறிஞ்சுதல் இங்கு HA புரதம் இருப்பதைக் குறிக்கிறது. பின்னர், வெளிப்படையாக, M புரதம், சவ்வின் அத்தகைய பகுதிகளின் உள் மேற்பரப்புடன் இணைந்து, எலக்ட்ரான்-அடர்த்தியான அடுக்கை உருவாக்குகிறது.அடுத்து, ரைபோநியூக்ளியோபுரோட்டீன் குறிப்பாக இந்தப் பகுதிகளில் உள்ள சவ்வுடன் பிணைக்கிறது, மேலும் சவ்வை வளைத்து நீட்டியதன் மூலம் வளரும் செயல்முறை நிகழ்கிறது. பிரிவு மற்றும் தொடர்புடைய ribonucleoprotein சுற்றியுள்ள.Polyacrylamide ஜெல் எலக்ட்ரோபோரேசிஸ் தரவு RNPs (Lazarowitz et al., 1971) விட பிளாஸ்மா மென்படலத்துடன் உறை புரதங்கள் விரைவாக இணைகிறது என்ற கருத்தை ஆதரிக்கிறது. வைரஸ் உறை, சுத்திகரிக்கப்பட்ட விரியன்களில் இத்தகைய பாலிபெப்டைடுகள் காணப்படுவதில்லை. ஏற்கனவே குறிப்பிட்டுள்ளபடி, நியூராமினிக் அமில எச்சங்கள் வளரும் இன்ஃப்ளூயன்ஸா வைரஸ் துகள்களின் உறைகளில் இல்லை, ஆனால் அவை செல் சவ்வின் அருகிலுள்ள பகுதிகளில் உள்ளன (க்ளெங்க் மற்றும் பலர்., 1970) .
இந்த தரவு வளரும் வைரஸ் துகள் மற்றும் அருகில் உள்ள செல் சவ்வு உறை இடையே இரசாயன கலவையில் ஒரு வியத்தகு மாற்றம் சான்றுகள் வழங்குகிறது.
இருப்பினும், மறுபுறம், வளரும் செயல்முறையின் ஒரு முக்கிய அம்சம் என்னவென்றால், வைரஸ் உறை புரவலன் கலத்தின் பிளாஸ்மா சவ்வுடன் தொடர்கிறது மற்றும் உருவவியல் ரீதியாக அதை ஒத்திருக்கிறது (கம்பன்ஸ் மற்றும் டிம்மாக், 1969). குறிப்பிட்டுள்ளபடி, இந்த சவ்வுகளில் உள்ள லிப்பிட்கள் ஹோஸ்ட் செல் சவ்வின் லிப்பிட்களுடன் மிக நெருக்கமான ஒற்றுமையைக் கொண்டுள்ளன. இந்த அவதானிப்புகள், பிளாஸ்மா மென்படலத்தில் உள்ள லிப்பிட்கள், ரேடியல் பரவல் மூலம் வளரும் வைரஸ் துகள்களில் உள்ள லிப்பிடுகளுடன் எளிதில் பரிமாறிக்கொள்ளும் என்று கூறுகின்றன.
இதன் விளைவாக, வளரும் வீரியனின் உறை, விரியன் உறை புரதங்களைச் சேர்ப்பதன் மூலம் மாற்றியமைக்கப்பட்ட உயிரணு சவ்வின் ஒரு சிறிய பகுதியிலிருந்து உருவாகிறது. இந்த கருத்து, நிச்சயமாக, பிளாஸ்மா மென்படலத்தில் உள்ள சவ்வின் அனைத்து கூறுகளின் தொகுப்பின் அவசியத்தை குறிக்கவில்லை.
உண்மையில், மென்படலத்தின் கூறுகள் உயிரணுக்களின் ஒரு பகுதியிலிருந்து மற்றொரு பகுதிக்கு கணிசமான தூரத்தை நகர்த்த வேண்டும் என்பது நீண்ட காலமாக அறியப்படுகிறது. ப்ரீட்னெல்ட் மற்றும் ஷாஃபர் (1957) இன்ஃப்ளூயன்ஸா வைரஸால் பாதிக்கப்பட்ட உயிரணுக்களில், HA* ஐ முதலில் காண முடியும் என்பதைக் காட்டியது.
கலத்தின் அனைத்துப் பகுதிகளிலும் நிகழ்கிறது மற்றும் அது பெரிநியூக்ளியர் மண்டலத்தில் அதிகரித்த செறிவில் உள்ளமைக்கப்படுகிறது. பின்னர், HA* ஃபிளேரின் "புறப் பகுதியில்" குவிந்து, ஃப்ளேர் மென்படலத்திலிருந்து நீண்டு செல்லும் மெல்லிய இழைகளிலும் காட்டப்படலாம்.
உறை கூறுகள் கலத்தின் உள்ளே இருந்து மேற்பரப்பிற்கு இடம்பெயர்கின்றன என்ற எண்ணம், செல் பின்னம் மற்றும் வெவ்வேறு செல் பின்னங்களில் உள்ள வைரஸ் புரதங்களின் பகுப்பாய்வு ஆகியவற்றைப் பயன்படுத்தி தொடர்ச்சியான ஆய்வுகள் மூலம் சமீபத்தில் உறுதிப்படுத்தப்பட்டு விரிவாக்கப்பட்டது. இந்த ஆய்வுகள், HA கிளைகோபுரோட்டீன் மற்றும் பிற உறை புரதங்கள், தோராயமான எண்டோபிளாஸ்மிக் ரெட்டிகுலத்தில் ஒருங்கிணைக்கப்படுகின்றன என்றும் கூறுகின்றன (காம்பன்ஸ், 1973a; க்ளெங்க் மற்றும் பலர்., 1974). துடிப்பு-துரத்தல் சோதனைகளில் வெளிப்படுத்தப்பட்டபடி, சில நிமிடங்களுக்குப் பிறகு எச்ஏ மென்மையான எண்டோபிளாஸ்மிக் ரெட்டிகுலத்தின் சவ்வுகளில் காணப்படுகிறது (கம்பன்ஸ், 1973a; ஸ்டான்லி மற்றும் பலர்., 1973; க்ளெங்க் மற்றும் பலர்., 1974) மற்றும் பிளாஸ்மா சவ்வு (ஸ்டான்லி மற்றும் அல்., 1974). ., 1973). மென்மையான எண்டோபிளாஸ்மிக் ரெட்டிகுலத்தில் இருந்து பிளாஸ்மா சவ்வு வரை துரத்தல் பரிசோதனைகள் செய்யப்படவில்லை என்றாலும், மென்மையான எண்டோபிளாஸ்மிக் ரெட்டிகுலத்தை கடந்து, கடினமான எண்டோபிளாஸ்மிக் ரெட்டிகுலத்தில் இருந்து பிளாஸ்மா சவ்வுக்கு HA இடம்பெயர்கிறது என்பது நம்பத்தகுந்ததாக தெரிகிறது. அத்தகைய இடம்பெயர்வின் முழு நேரத்திலும், HA மற்றும் பிற சவ்வு புரதங்கள் அவை நகரும் சவ்வுகளின் ஒருங்கிணைந்த பகுதியாகும் என்பதை கவனத்தில் கொள்ள வேண்டும்; OBI ஒருபோதும் கரைந்த புரதங்களாகக் காணப்படவில்லை.
முதன்மையாக எண்டோபிளாஸ்மிக் ரெட்டிகுலத்தில் இருந்து பெறப்பட்டதாக நம்பப்படும் மென்மையான சவ்வு பின்னங்களில், அனைத்து முக்கிய உறை புரதங்களும் காணப்படுகின்றன (காம்பன்ஸ் 1973a; க்ளெங்க் மற்றும் பலர்., 1974). இருப்பினும், அவற்றின் ஒப்பீட்டு அளவுகள் பிளாஸ்மா சவ்வு மற்றும் விரியன் ஆகியவற்றிலிருந்து வேறுபடுகின்றன (ஸ்டான்லி மற்றும் பலர், 1973; க்ளெங்க் மற்றும் பலர்., 1974). எம் புரதம் மற்றும் கிளைகோபுரோட்டீன் HA விகிதம் எண்டோபிளாஸ்மிக் ரெட்டிகுலத்தின் சவ்வுகளை விட முதிர்ந்த விரியன் உறையில் அதிகமாக உள்ளது. HA கிளைகோபுரோட்டீனைக் கொண்டு செல்லும் சிறிய அளவிலான சவ்வுகள் மட்டுமே வைரஸ் உறைகளாக மாற்றப்படுகின்றன, அதாவது கார்போஹைட்ரேட் இல்லாத புரதங்களைக் கொண்ட சவ்வு பின்னங்கள். ஏற்கனவே குறிப்பிட்டுள்ளபடி, M புரதத்தின் தொகுப்பு வைரஸ் அசெம்பிளியின் செயல்முறையை கட்டுப்படுத்தும் கட்டமாக இருக்கலாம்.
வெவ்வேறு உறைப் புரதங்களின் தொகுப்பு விகிதத்தில் உள்ள வேறுபாடு, உறையின் அசெம்பிளி ஒரு மல்டிஸ்டேஜ் செயல்முறை என்ற கருதுகோளை ஆதரிக்கிறது.இந்த கருத்து HA* உருவாகும் செயல்முறையின் கேள்வியுடன் ஒத்துப்போகிறது, இதில் கார்போஹைட்ரேட் பகுதியின் வரிசைமுறை சேர்த்தல் மற்றும் முதன்மை மரபணு உற்பத்தியின் இடம்பெயர்வின் போது புரோட்டியோலிடிக் பிளவு.
VIII. ஃப்ளூ வைரஸின் வெளியீடு
புரவலன் கலத்திலிருந்து இன்ஃப்ளூயன்ஸா வைரஸை வெளியிடுவதில் சிக்கல்,
வைரஸ் செயல்பாட்டின் சிக்கலுடன் நெருக்கமாக தொடர்புடையதாக தோன்றுகிறது
NA*, இது ஏற்கனவே விரிவாக விவாதிக்கப்பட்டது (பார்க்க
வழக்குகள் V மற்றும் ch. 4) இந்த நொதி முக்கிய பங்கு வகிக்கிறது என்பது உண்மை
வைரஸின் வெளியீட்டில் பங்கு, எதிர்ப்பின் திறனில் இருந்து பெறப்பட்டது
NA*க்கு குறிப்பிட்ட உடல்கள் அத்தகைய வெளியீட்டை அடக்குகின்றன (செ-
டு, ராட், 1966; வெப்ஸ்டர் மற்றும் பலர். G968). மேலும், அத்தகைய ஆன்டிபாடிகள்
எரித்ரோசைட்டுகளில் இருந்து வைரஸ் வெளியேற்றத்தைத் தடுக்கவும் (பிரவுன், லேவர்,
1968). பாக்டீரியா NA*, இது ஆன்டிபாடிகளால் தடுக்கப்படவில்லை
லாமி முதல் வைரஸ் NA* வரை, உயிரணுக்களிலிருந்து வைரஸை வெளியிடும் திறன் கொண்டது,
அத்தகைய ஆன்டிபாடிகள் மூலம் சிகிச்சை அளிக்கப்பட்டது (கம்பன்ஸ் மற்றும் பலர், 1969;
வெப்ஸ்டர், 1970). மறுபுறம், டிவலன்ட் ஆன்டிபாடிகள்
NA க்கு வைரஸ் திரட்டலையும் ஏற்படுத்துகிறது (செட்டோ மற்றும் சாங், 1969;
கம்பன்ஸ் மற்றும் பலர்., 1969; வெப்ஸ்டர், 1970), மற்றும் மோனோவலன்ட் எதிர்ப்பு
உடல்கள் வைரஸின் வெளியீட்டைத் தடுக்காது, இருப்பினும் அவை தடுக்கின்றன
90% க்கும் அதிகமான நியூராமினிடேஸ் செயல்பாடு (பெக்ட் மற்றும் பலர், 1971).
இந்த தரவுகள் அனைத்தும் ஒன்றாகக் கூறுகின்றன
டைவலன்ட் ஆன்டிபாடிகள் வைரஸின் வெளியீட்டில் தலையிடுகின்றன
மீது இருக்கும் ஆன்டிஜென்களுடன் பிணைப்பதன் மூலம்
செல் மேற்பரப்பு, மற்றும் நொதிகளின் செயல்பாட்டைத் தடுப்பதன் மூலம்
போலீஸ்காரர். காட்சி வைரஸின் வெளியீட்டில் நியூராமினிடேஸின் பங்கு
அல்லது பலீஸ் மற்றும் பலர். (G974), யார் இந்த ஃபெர் என்று நிறுவினார்
vi இலிருந்து நியூரோஅமிலிக் அமிலத்தை அகற்றுவதற்கு ment அவசியம்
விரியன்கள் திரட்டப்படுவதைத் தவிர்க்க ரஷ்ய மேற்பரப்பு - பின்னர் -
செல் மேற்பரப்பில் kov.
IX. இனப்பெருக்கத்தின் அசாதாரண வடிவங்கள்
A. புரவலன் கலத்தைப் பொறுத்து மறுஉற்பத்தி நிறுத்தப்படும்
இன்ஃப்ளூயன்ஸா வைரஸ்கள் பரவலான ஹோஸ்ட் செல்களை பாதிக்கலாம். இருப்பினும், பல பாதிக்கப்பட்ட உயிரணுக்களில், தொற்று சந்ததியினரின் விளைச்சல் மிகக் குறைவாகவோ அல்லது கண்டறிய முடியாததாகவோ உள்ளது, இருப்பினும் வைரஸ் கூறுகளை சாதாரண டைட்டர்களில் கண்டறியலாம்.தொற்று சுழற்சியின் இந்த வகை ஹோஸ்ட் செல் சார்ந்த குறுக்கீடு கருக்கலைப்பு தொற்று என அழைக்கப்படுகிறது. இன்ஃப்ளூயன்ஸா வைரஸின் நியூரோட்ரோபிக் அல்லாத விகாரங்களால் மூளைக்குள் தொற்று சுழற்சி முதலில் எலிகளில் காணப்பட்டது. இன்ஃப்ளூயன்ஸா A வைரஸ் அமைப்புகள் விவரிக்கப்பட்டுள்ளன, இதில் RNP-^ மட்டுமே ஆன்டிஜென் மற்றும் ஹெமாக்ளூட்டினின் உற்பத்தி செய்யப்பட்டது, ஆனால் ஒரு தொற்று வைரஸ் அல்ல.இதுவரை ஆய்வு செய்யப்பட்ட அனைத்து ENT அமைப்புகளிலும், RNP ஆன்டிஜென் கருவில் குவிந்து கண்டறியப்படவில்லை.
சைட்டோபிளாஸில் உள்ள ஃப்ளோரசன்ட் ஆன்டிபாடிகளின் உதவியுடன் ஆயுதம் ஏந்தப்பட்டது (ஹென்லே மற்றும் பலர், 1955; ஃபிராங்க்ளின், ப்ரீடன்ஃபெல்ட், 1959; டெர் மியூலன், லவ், 1967; ஃப்ரேசர், 1967).
பி வான் மேக்னஸ் நிகழ்வு
1 (பாரி, 1961) ஐ விட அதிக அளவில் இன்ஃப்ளூயன்ஸா வைரஸ்களின் தொடர் பத்திகளின் போது, புரவலன் கலத்திலிருந்து வெளிப்படும் முழுமையற்ற வைரஸின் அளவு அதிகரிக்கிறது (வான் மேக்னஸ், 1951, 1952) இந்த வைரஸ் துகள்கள் மேற்பரப்பு அமைப்பைக் கொண்டுள்ளன. தொற்று வைரஸின் அமைப்பு, நோயெதிர்ப்புத் திறன் கொண்டவை: மற்றும் ஹோமோலோகஸ் குறுக்கீட்டை ஏற்படுத்துகின்றன. அவை குறைவான RNA மற்றும் RNP ஆன்டிஜெனைக் கொண்டிருக்கின்றன, ஹீமாக்ளூட்டினேட்டிங் செயல்பாட்டிற்கு குறைவான தொற்றுநோயை வெளிப்படுத்துகின்றன மற்றும் முழுமையான வைரஸ் துகள்களைக் காட்டிலும் அதிக கொழுப்பு அமிலங்களைக் கொண்டிருக்கின்றன (வான் மேக்னஸ், 1954; ஐசக்ஸ், 1959; Pauker மற்றும் பலர்., 1959; Rott and Schafer, 1961; Rott and Scholtissek, 1963).
ஒரு பகுதி வைரஸின் ஆர்என்ஏவை பகுப்பாய்வு செய்யும் போது, ஒப்பீட்டளவில் அதிக மூலக்கூறு எடை கொண்ட வைரஸ் ஆர்என்ஏ இல்லாதது அல்லது குறைந்த அளவுகளில் இருப்பது கண்டறியப்பட்டது, அதே சமயம் குறைந்த மூலக்கூறு எடை கொண்ட ஆர்என்ஏ அளவு அதிகரிக்கிறது (டூஸ்பெர்க், 1968; போன்ஸ், ஹிர்ஸ்ட், 1969; நாயக், 1969) .
இன்ஃப்ளூயன்ஸா வைரஸின் இரண்டாவது நீர்த்த பத்தியில் பாதிக்கப்பட்ட உயிரணுக்களில், வைரஸின் அனைத்து மரபணு தகவல்களும் உள்ளன, ஏனெனில் இந்த உயிரணுக்களிலிருந்து தனிமைப்படுத்தப்பட்ட cfRNA கலப்பினத்திற்குப் பிறகு, தொற்று வைரஸிலிருந்து தனிமைப்படுத்தப்பட்ட RNAவை முற்றிலும் RNA அசோரெசிஸ்டண்ட் வடிவமாக மாற்றும் திறன் கொண்டது. (Scholtissek, Rott, 1969b). இவ்வாறு, முழுமையற்ற துகள்களில் குறைந்த மூலக்கூறு எடை ஆர்.என்.ஏ அளவு அதிகரிப்பது அதிக மூலக்கூறு எடை ஆர்.என்.ஏ காரணமாக இருக்கலாம், இந்த துகள்களில் அழிக்கப்பட்ட மற்றும் செயல்படாத மூலக்கூறுகளின் வடிவத்தில் சேர்க்கப்படலாம். இந்த யோசனையானது தாகத்தால் நீர்த்தப்படாத பத்தியில், தொற்று வைரஸை உருவாக்கும் திறன் முதலில் குறைகிறது, அதன் பிறகு ஹெமாக்ளூட்டினின், நியூராமினிடேஸ் மற்றும் இறுதியாக, RNP ஆன்டிஜென்களின் தொகுப்பு குறைகிறது (Scholtissek et al., 1966).
நாயக் (1972) நாயக் (1972) முதல் உயர்-பன்மடங்கு பத்தியின் போது, ஆரம்பத்தில் வெளிவந்த வைரஸ் முழுமையாக தொற்றும் தன்மை கொண்டது மற்றும் சுக்ரோஸ் சாய்வில் தொற்று வைரஸ் RNA துண்டுகளின் இயல்பான வடிவத்தை உருவாக்கியது, ஆனால் பின்னர் வெளிவரும் வைரஸ் முழுமையற்ற ஒரு RNA சுயவிவரத்தைக் கொண்டிருந்தது ( பின்னணி) -மேக்னஸ்) வைரஸ்1.
- ஆண்களில் டைஹைட்ரோடெஸ்டோஸ்டிரோன் - செயல்பாடு, விதிமுறை மற்றும் நோயியல்
- இன்சுலின் பெறுதல்: அனைத்து முக்கிய வழிகளும்
- ஸ்டெராய்டுகள் புரோஸ்டேட் சுரப்பியை எவ்வாறு பாதிக்கின்றன பாடத்தின் போது புரோஸ்டேட்டை எவ்வாறு பாதுகாப்பது
- வைரஸ் அல்ல, புரதம் அல்ல, ஆனால் அதன் பெயர் ப்ரியான். சுருக்கமாக ப்ரியான்ஸ்
- வயிற்றுப் புண்களுக்கு சரியான ஊட்டச்சத்து
- ஸ்கோலியோசிஸ் சிகிச்சை முதுகு மசாஜ் வேறுபடுத்தப்பட்ட முதுகு மசாஜ் 10 15
- வீட்டில் மூச்சுக்குழாயில் இருந்து சளியை எவ்வாறு அகற்றுவது
- புற்றுநோய் கழுத்து ஆலை. பாம்பு மலை ஏறுபவர். புற்றுநோய் கழுத்து வேர்
- கொம்புச்சாவின் நன்மைகள் என்ன?
- சொட்டு மருந்து என்றால் என்ன: வகைகள் மற்றும் சிகிச்சை
- சிறுநீரக சிகிச்சைக்கான ஆளி விதைகள்
- இன்ஃப்ளூயன்ஸா வைரஸ் எவ்வாறு செயல்படுகிறது?
- அதிகப்படியான புரதம்: இது எவ்வளவு தீங்கு விளைவிக்கும்?
- ஊக்கமருந்து கட்டுப்பாட்டின் போது டெஸ்டோஸ்டிரோன் தரநிலைகள்
- சிக்கலான சிகிச்சைக்கு அட்ரோபின் சரியாக எப்படி பயன்படுத்துவது அட்ரோபின் பண்ணை நடவடிக்கை
- ஆண்களில் ஹைபோகோனாடிசம் என்றால் என்ன, இந்த நோய்க்கு எவ்வாறு சிகிச்சையளிப்பது
- மணிக்கட்டு மூட்டு என்பது மேல் மூட்டுக்கான சரியான மோட்டார் கருவியாகும்
- பாஸ்பாடிடைல்கோலின் - கொழுப்பு எரியும் ஊசி
- பெண்கள் மற்றும் ஆண்களில் டைஹைட்ரோடெஸ்டோஸ்டிரோன் எப்போது உயர்கிறது?
- தைராய்டு சுரப்பியின் தைரோடாக்சிகோசிஸிற்கான உணவு தைரோடாக்சிகோசிஸுக்கு என்ன உணவுகள் அனுமதிக்கப்படவில்லை