Replikasi virus influenza terjadi di. Bagaimana cara kerja virus influenza? Identifikasi virus influenza menggunakan RTG
Mereka adalah parasit obligat intraseluler, artinya mereka tidak dapat mereplikasi atau mewariskan gen mereka tanpa bantuan. Sebuah partikel virus (virion) sendirinya bersifat inert. Ketika virus menginfeksi sel, ia menggunakan enzim dan sebagian besar struktur sel untuk bereplikasi.
Berbeda dengan proses pembelahan sel seperti dan, replikasi virus menghasilkan banyak keturunan yang menghancurkan sel inang dan kemudian menginfeksi sel lain di dalam tubuh.
Materi genetik virus
Virus dapat mengandung DNA atau RNA beruntai tunggal/untai ganda. Jenis materi genetik yang terdapat pada suatu virus tertentu bergantung pada sifat dan fungsinya. Sifat sebenarnya dari apa yang terjadi setelah inang terinfeksi bervariasi tergantung pada sifat virusnya.
Proses replikasi akan berbeda untuk virus dsDNA, ssDNA, dsRNA, dan RNA untai tunggal. Misalnya, virus DNA beruntai ganda biasanya harus memasuki sel inang sebelum dapat bereplikasi. Namun, virus RNA beruntai tunggal terutama bereplikasi ke dalam sel inang.
Setelah virus menginfeksi inang, komponen keturunan virus diproduksi oleh mesin seluler, dan perakitan kapsid virus merupakan proses non-enzimatik. Virus biasanya hanya dapat menginfeksi sejumlah host tertentu. Mekanisme “gembok dan kunci” adalah penjelasan paling umum untuk fenomena ini. Protein tertentu pada partikel virus harus cocok dengan protein reseptor tertentu pada permukaan sel inang tertentu.
Bagaimana virus menginfeksi sel?
Proses dasar infeksi dan replikasi virus terjadi dalam 6 tahap:
- Adsorpsi - virus berikatan dengan sel inang.
- Masuk - virus memasukkan genomnya ke dalam sel inang.
- Replikasi genom virus - Genom virus direplikasi menggunakan struktur seluler inang.
- Perakitan - komponen virus dan enzim terbentuk dan mulai berkumpul.
- Pematangan - virus berkembang dari komponen yang dirakit.
- Keluar - virus baru keluar dari sel inang untuk mencari korban baru untuk diinfeksi.
Virus dapat menginfeksi semua jenis sel, termasuk
Keluarga orthomyxovirus (Yunani orthos - benar, tukha - lendir) termasuk virus influenza tipe A, B, C, yang, seperti paramyxovirus, memiliki afinitas terhadap musin. Virus influenza A menginfeksi manusia dan beberapa spesies hewan (kuda, babi, dll) dan burung. Virus influenza tipe B dan C hanya bersifat patogen bagi manusia. Virus influenza manusia pertama diisolasi dari manusia pada tahun 1933 oleh W. Smith, C. Andrews dan P. Ladow (strain WS) dengan menginfeksi musang putih. Belakangan, virus ini diklasifikasikan menjadi tipe A. Pada tahun 1940, T. Francis dan T. Megill menemukan virus influenza tipe B, dan pada tahun 1949, R. Taylor menemukan virus influenza tipe C. Saat mengklasifikasikan virus influenza, kesulitan-kesulitan tertentu selalu terjadi. telah ditemui, terkait dengan variabilitas antigeniknya. Virus influenza dibagi menjadi tiga tipe A, B dan C. Tipe A mencakup beberapa subtipe yang berbeda satu sama lain dalam antigennya - hemagglutinin dan neuraminidase. Menurut klasifikasi WHO (1980), virus influenza manusia dan hewan tipe A dibagi menjadi 13 subtipe antigenik berdasarkan hemagglutinin (H1-H13) dan 10 subtipe berdasarkan neuraminidase (N1-N10). Dari jumlah tersebut, virus influenza manusia tipe A mencakup tiga hemagglutinin (HI, H2 dan NZ) dan dua neuraminidase (N1 dan N2).Untuk virus tipe A, subtipe hemagglutinin dan neuraminidase ditunjukkan dalam tanda kurung. Misalnya virus influenza A: Khabarovsk/90/77 (H1N1).Struktur dan komposisi kimia
Virus influenza berbentuk bulat dengan diameter 80-120 nm. Bentuk seperti benang lebih jarang ditemukan. Nukleokapsid simetri heliks adalah untai ribonukleoprotein (RNP) yang tersusun dalam heliks ganda yang membentuk inti virion. RNA polimerase dan endonuklease (P1 dan P3) berhubungan dengannya. Inti dikelilingi oleh membran yang terdiri dari protein M, yang menghubungkan RNP dengan lapisan ganda lipid pada kulit terluar dan proses styloid yang terdiri dari hemagglutinin dan neuraminidase.Virion mengandung sekitar 1% RNA, 70% protein, 24% lipid dan 5 % karbohidrat. Lipid dan karbohidrat adalah bagian dari lipoprotein dan glikoprotein kulit terluar dan berasal dari sel. Genom virus diwakili oleh molekul RNA terfragmentasi untai minus. Virus influenza tipe A dan B memiliki 8 fragmen RNA, 5 di antaranya mengkode satu protein, dan 3 fragmen terakhir masing-masing mengkode dua protein.Antigen
Virus influenza A, B dan C berbeda satu sama lain dalam antigen spesifik tipe yang terkait dengan RNP (protein NP) dan protein M-matriks, yang menstabilkan struktur virion.Antigen ini terdeteksi di RSC. Spesifisitas yang lebih sempit dari virus tipe A ditentukan oleh dua antigen permukaan lainnya - hemagglutinin H dan neuraminidase N, yang ditandai dengan nomor seri.Hemagglutinin adalah glikoprotein kompleks dengan sifat pelindung. Ini menginduksi pembentukan antibodi penetral virus di dalam tubuh - antihemagglutinin, yang terdeteksi di RTGA. Variabilitas hemagglutinin (antigen H) menentukan pergeseran antigenik dan pergeseran virus influenza. Penyimpangan antigenik mengacu pada perubahan kecil pada antigen H yang disebabkan oleh mutasi titik pada gen yang mengontrol pembentukannya. Perubahan tersebut dapat terakumulasi pada keturunannya di bawah pengaruh faktor selektif seperti antibodi. Hal ini pada akhirnya mengarah pada pergeseran kuantitatif, yang dinyatakan dalam perubahan sifat antigenik hemagglutinin. Dengan pergeseran antigenik, terjadi penggantian gen secara lengkap, yang mungkin didasarkan pada rekombinasi antara dua virus. Hal ini menyebabkan perubahan subtipe hemaglutinin atau neuraminidase, dan kadang-kadang kedua antigen, dan munculnya varian antigenik baru yang mendasar dari virus, yang menyebabkan epidemi dan pandemi besar.Hemagglutinin juga merupakan reseptor yang melaluinya virus teradsorpsi pada sel-sel sensitif. , termasuk eritrosit, menyebabkannya saling menempel , dan terlibat dalam hemolisis sel darah merah.Viral neuraminidase adalah enzim yang mengkatalisis pembelahan asam sialat dari substrat. Ia memiliki sifat antigenik dan pada saat yang sama berpartisipasi dalam pelepasan virion dari sel inang. Neuraminidase, seperti hemagglutinin, berubah akibat pergeseran dan pergeseran antigenik.Budidaya dan reproduksi
Virus influenza dibudidayakan dalam embrio ayam dan kultur sel. Lingkungan yang optimal adalah embrio ayam, di dalam rongga ketuban dan alantoik tempat virus berkembang biak dalam waktu 36-48 jam.Yang paling sensitif terhadap virus influenza adalah kultur primer sel ginjal embrio manusia dan beberapa hewan. Reproduksi virus dalam kultur ini disertai dengan CPE ringan, yang mengingatkan pada degenerasi sel spontan. Virus influenza teradsorpsi pada reseptor glikoprotein sel epitel, di mana mereka menembus melalui endositosis reseptor. Transkripsi dan replikasi genom virus terjadi di inti sel. Dalam hal ini, fragmen RNA individu yang dibaca dalam bentuk m-RNA diterjemahkan ke dalam ribosom, tempat sintesis protein spesifik virus terjadi. Setelah replikasi genom virus, kumpulan RNA virus terbentuk, yang digunakan dalam perakitan nukleokapsid baru.Patogenesis
Reproduksi primer virus terjadi di sel epitel saluran pernafasan. Melalui permukaan selaput lendir yang terkikis, virus memasuki darah sehingga menyebabkan viremia. Peredaran virus dalam darah disertai dengan kerusakan sel endotel kapiler darah, sehingga terjadi peningkatan permeabilitasnya. Dalam kasus yang parah, perdarahan terjadi di paru-paru, otot jantung, dan organ dalam lainnya. Virus influenza, memasuki kelenjar getah bening, merusak limfosit, mengakibatkan defisiensi imun didapat, yang berkontribusi pada terjadinya sekunder infeksi bakteri... Dengan influenza, terjadi keracunan tubuh dengan tingkat keparahan yang bervariasi.Kekebalan
Mekanisme imunitas anti influenza berhubungan dengan faktor alami perlindungan nonspesifik antivirus, terutama dengan produksi interferon dan sel pembunuh alami.Imunitas spesifik disediakan oleh faktor respon seluler dan humoral. Yang pertama diwakili oleh makrofag dan T-killer. Yang kedua adalah imunoglobulin, terutama antibodi antihemagglutinin dan antineurominidase, yang memiliki sifat penetral virus. Yang terakhir, tidak seperti antihemagglutinin, hanya menetralkan sebagian virus influenza, mencegah penyebarannya. Antibodi pengikat komplemen terhadap nukleoprotein virus tidak memiliki sifat perlindungan bahkan setelah 1,5 bulan. menghilang dari darah orang yang baru sembuh.Antibodi terdeteksi dalam serum darah 3-4 hari setelah timbulnya penyakit dan mencapai titer maksimum setelah 2-3 minggu. Durasi kekebalan spesifik yang diperoleh setelah infeksi influenza, bertentangan dengan kepercayaan sebelumnya, diukur dalam beberapa dekade. Kesimpulan ini diambil berdasarkan studi struktur usia kejadian influenza yang disebabkan oleh virus A (H1N1) pada tahun 1977. Diketahui bahwa virus yang sudah tidak ada sejak tahun 1957 ini hanya menyerang orang di bawah usia 20 tahun. pada tahun 1977. Jadi, setelah menderita infeksi influenza yang disebabkan oleh virus influenza tipe A, terbentuk kekebalan yang kuat, yang sangat spesifik terhadap subtipe virus (oleh antigen H dan N) yang menyebabkan pembentukannya. kekebalan pasif akibat antibodi IgG terhadap virus subtipe A yang sesuai. Kekebalan bertahan selama 6-8 bulan.Epidemiologi
Sumber penularannya adalah orang sakit dan pembawa virus. Penularan patogen terjadi melalui tetesan udara. Influenza merupakan infeksi epidemi yang lebih sering terjadi pada musim dingin dan musim dingin-musim semi. Kira-kira setiap sepuluh tahun, epidemi influenza menjadi pandemi, mempengaruhi populasi di berbagai benua. Hal ini dijelaskan oleh perubahan antigen H dan N dari virus tipe A yang berhubungan dengan pergeseran dan pergeseran antigenik. Misalnya saja virus influenza A dengan hemagglutinin NSW1 yang menyebabkan pandemi flu Spanyol pada tahun 1918 yang merenggut 20 juta nyawa manusia. Pada tahun 1957, virus influenza “Asia” (H2N2) menyebabkan pandemi yang mempengaruhi lebih dari 2 miliar orang. Pada tahun 1968, muncul varian pandemi baru yaitu virus influenza A (H3N2), yang disebut virus Hong Kong, yang terus beredar hingga saat ini. Pada tahun 1977, virus ini bergabung dengan virus tipe A (H1N1), yang merupakan hal yang tidak terduga, karena virus yang sama telah beredar pada tahun 1947-1957, dan kemudian digantikan sepenuhnya oleh subtipe “Asia”. Dalam hal ini, muncul hipotesis bahwa pergeseran varian virus bukanlah hal baru dalam sejarah. Mereka mewakili serosubtipe yang beredar di tahun-tahun terakhir... Penghentian peredaran virus influenza yang menyebabkan epidemi berikutnya dijelaskan oleh kekebalan kolektif populasi yang telah berkembang terhadap varian antigenik dari patogen tersebut. Dengan latar belakang tersebut, terdapat seleksi varian antigenik baru yang belum terbentuk kekebalan kolektifnya.Belum jelas di mana pergeseran varian antigenik (serosubtipe) virus influenza A yang keluar dari peredaran aktif dalam satu atau periode sejarah lain dipertahankan untuk waktu yang lama. Ada kemungkinan bahwa sumber persistensi virus tersebut adalah hewan liar dan peliharaan, terutama burung, yang terinfeksi virus influenza tipe A varian manusia dan mempertahankan peredarannya dalam waktu yang lama. Pada saat yang sama, rekombinasi genetik antara virus unggas dan virus manusia terjadi di dalam tubuh burung, yang mengarah pada pembentukan varian antigenik baru.Menurut hipotesis lain, virus influenza dari semua subtipe yang diketahui terus-menerus beredar di antara populasi, tetapi menjadi relevan secara epidemi. hanya dengan penurunan imunitas kolektif.Virus influenza tipe B dan C ditandai dengan stabilitas antigenik yang lebih tinggi. Virus influenza B menyebabkan epidemi yang tidak terlalu intens dan wabah lokal. Virus influenza tipe C merupakan penyebab penyakit sporadis.Virus influenza cepat dimusnahkan oleh suhu di atas 56°C, radiasi UV, disinfektan, dan deterjen. Itu tetap bertahan selama 1 hari. pada suhu kamar, pada permukaan logam dan plastik halus - hingga 2 hari. Virus influenza bertahan hidup pada suhu rendah (-70°C).Pencegahan khusus
Untuk pencegahan influenza, digunakan rimantadine, yang menekan reproduksi virus influenza tipe A. Untuk pencegahan pasif, digunakan imunoglobulin anti-influenza manusia, yang diperoleh dari serum darah donor yang diimunisasi dengan vaksin influenza. Interferon leukosit manusia memiliki efek tertentu.Vaksin hidup dan tidak aktif digunakan untuk pencegahan vaksin. Ketika vaksin hidup diberikan, kekebalan umum dan lokal terbentuk. Selain itu, induksi interferon juga dicatat.Saat ini, berbagai jenis vaksin yang tidak aktif telah diperoleh: virion, subunit, split dan campuran. Vaksin virion diproduksi melalui pemurnian virus berkualitas tinggi yang ditanam dalam embrio ayam. Vaksin subunit adalah antigen permukaan virus influenza yang dimurnikan - hemagglutinin dan neuraminidase. Persiapan vaksin tersebut ditandai dengan berkurangnya reaktogenisitas dan imunogenisitas yang tinggi. Vaksin yang dibelah atau didisintegrasi dibuat dari suspensi virion yang dimurnikan melalui pengolahan dengan deterjen. Namun, masih belum ada konsensus mengenai keunggulan salah satu vaksin tersebut. Vaksin yang tidak aktif menginduksi respons imun dalam sistem imunitas humoral umum dan lokal, tetapi menginduksi sintesis interferon pada tingkat yang lebih rendah dibandingkan dengan vaksin hidup.Pengalaman bertahun-tahun dalam penggunaan vaksin hidup dan vaksin yang tidak aktif menunjukkan bahwa ketidakcocokan antigenik antara strain vaksin dengan vaksin yang dilemahkan. epidemi adalah penyebab utama, tetapi bukan satu-satunya alasan rendahnya efektivitas pencegahan vaksin influenza. Dalam beberapa tahun terakhir, upaya telah dilakukan untuk menciptakan vaksin influenza yang direkayasa secara genetik dan sintetis.Flu
Influenza merupakan penyakit pernafasan akut pada manusia yang cenderung menyebar secara epidemik. Hal ini ditandai dengan peradangan catarrhal pada saluran pernapasan bagian atas, demam, dan keracunan umum yang parah. Influenza sering disertai komplikasi parah - pneumonia bakterial sekunder, eksaserbasi penyakit paru-paru kronis.Patogen influenza termasuk dalam keluarga Orthomyxoviridae. Ini mencakup tiga jenis virus - A, B, C. Virus influenza berbentuk bola, ukurannya 80-120 nm. Terkadang virion berfilamen terbentuk. Genom dibentuk oleh RNA untai minus beruntai tunggal, yang terdiri dari delapan fragmen, dan dikelilingi oleh kapsid protein. RNA terkait dengan 4 protein internal: nukleoprotein (NP) dan protein dengan berat molekul tinggi PI, P2, R3, terlibat dalam transkripsi genom dan replikasi virus. Nukleokapsid memiliki tipe simetri heliks. Di atas cangkang kapsid terdapat lapisan protein matriks (protein M). Pada bagian luar terdapat cangkang superkapsid, hemaglutinin (H) dan neuraminidase (N) yang terletak berbentuk duri. Kedua glikoprotein (N dan H) memiliki sifat antigenik. Pada virus influenza, ditemukan 13 jenis antigenik hemagglutinin (NI-13) yang berbeda dan 10 varian neuraminidase (N1-10).Berdasarkan antigen nukleoprotein internal, tiga jenis virus influenza dibedakan - A, B, C, yang dapat ditentukan di RSC. Virus tipe A yang menginfeksi manusia memiliki tiga jenis hemagglutinin (HI, H2, H3) dan dua neuraminidase (N1, N2). Tergantung pada kombinasinya, varian virus influenza A dibedakan - H1N1, H2N2, H3N2. mereka ditentukan dalam reaksi penghambatan hemaglutinasi dengan serum yang sesuai.Virus influenza mudah dibudidayakan dalam embrio ayam dan berbagai kultur sel. Akumulasi virus maksimal terjadi setelah 2-3 hari. Di lingkungan luar, virus dengan cepat kehilangan daya menularnya karena kekeringan. Pada suhu rendah di lemari es disimpan selama seminggu, pada -70 ° C - lebih lama. Pemanasan menyebabkannya menjadi tidak aktif setelah beberapa menit. Di bawah pengaruh eter, fenol, formaldehida, ia cepat rusak.Metode diagnostik virologi
Bahan penelitiannya adalah usapan nasofaring, sekret hidung yang diambil dengan kapas steril kering atau basah pada hari pertama sakit, dahak. Virus dapat ditemukan dalam darah dan cairan serebrospinal. Dalam kasus yang fatal, potongan jaringan yang terkena pada saluran pernapasan atas dan bawah, otak, dll diangkat, dan usap nasofaring diambil saat perut kosong. Pasien harus berkumur tiga kali dengan larutan garam natrium klorida steril (10-15 ml), yang ditampung dalam toples steril berleher lebar. Setelah itu, bersihkan bagian belakang faring dan saluran hidung dengan kapas steril, lalu celupkan ke dalam toples berisi bilasan.Anda dapat mengambil bahan tersebut dengan kapas steril yang dibasahi larutan natrium klorida, yang digunakan untuk bersihkan dinding belakang faring secara menyeluruh. Setelah bahan dikumpulkan, kapas direndam dalam tabung reaksi yang berisi larutan fisiologis, yang ditambahkan 5% serum hewan yang tidak aktif. Di laboratorium, penyeka dibilas dengan cairan, diperas pada sisi tabung, dan dikeluarkan. Tiriskan disimpan di lemari es hingga mengendap, kemudian cairan bagian tengahnya ditampung ke dalam tabung steril. Antibiotik penisilin (200-1000 IU/ml), streptomisin (200-500 μg/ml), nistatin (100-1000 IU/ml) ditambahkan ke bahan untuk menghancurkan mikroflora yang menyertainya, disimpan selama 30 menit pada suhu kamar dan digunakan untuk mengisolasi virus, setelah sebelumnya diperiksa sterilitasnya Metode sensitif untuk mengisolasi virus yang menginfeksi embrio ayam umur 10-11 hari. Bahan dalam volume 0,1-0,2 ml disuntikkan ke dalam rongga ketuban atau allantois. Biasanya, 3-5 embrio terinfeksi. Embrio diinkubasi pada suhu optimal 33-34°C selama 72 jam. Untuk meningkatkan jumlah virion dalam bahan uji, bahan tersebut dikonsentrasikan terlebih dahulu. Untuk melakukan ini, mereka menggunakan metode adsorpsi virus pada sel darah merah ayam, pengobatan dengan larutan trypsin 0,2% untuk meningkatkan sifat infeksi virus, atau mengendapkannya menggunakan metode khusus.Setelah inkubasi, embrio ayam didinginkan pada suhu tertentu. suhu 4°C selama 2-4 jam, kemudian disedot secara steril dengan pipet atau spuit, cairan alantoik atau ketuban. Dalam hal ini, keberadaan virus menular ditentukan menggunakan RGA. Untuk melakukan ini, campurkan bahan tahan virus dengan volume yang sama (0,2 ml) dan suspensi 1% sel darah merah ayam. Reaksi positif (adanya virus pada bahan) ditandai dengan mengendapnya eritrosit berbentuk payung, bila pada bahan terdapat virus yang mempunyai sifat hemaglutinasi, maka dititrasi menggunakan RGA yang diperluas untuk menentukan titer aktivitas hemaglutinasi. Dengan menggunakan reaksi ini, titer virus hemaglutinasi ditentukan - pengenceran bahan tertinggi yang masih menghasilkan reaksi hemaglutinasi. Jumlah virus ini diambil sebagai satu unit hemagglutinous (HAU).Identifikasi virus influenza menggunakan RTGA
Untuk melakukan ini, pertama-tama siapkan pengenceran bahan virus yang berfungsi, yang mengandung 4 GAO virus dalam volume tertentu.Reaksi diperhitungkan setelah pembentukan sedimen eritrosit di sumur kontrol. Reaksi positif ditunjukkan dengan tertundanya hemaglutinasi pada sumur uji.Virus influenza dapat diisolasi menggunakan berbagai jalur kultur sel - embrio manusia, ginjal monyet, garis sel ginjal anjing kontinu (MDCK) dan lain-lain. Dalam kultur sel, efek sitopatik virus dimanifestasikan (penampakan sel dengan tepi bergerigi, vakuola, pembentukan inklusi intranuklear dan sitoplasma), yang berakhir dengan degenerasi lapisan tunggal sel. Untuk mengidentifikasi virus yang diisolasi, RTGA digunakan (asalkan titer hemaglutinin dalam cairan kultur minimal 1:8). Selain reaksi ini, Anda dapat menggunakan RGGads, namun kurang sensitif dan memerlukan titer serum imun minimal 1:160 serta RSK, RN, REMA, dll.Studi serologis
Pengujian serologis digunakan untuk memastikan diagnosis influenza. Hal ini didasarkan pada penentuan peningkatan empat kali lipat titer antibodi dalam serum pasien.Serum pertama diperoleh pada awal penyakit pada periode akut (2-5-1 hari sakit), yang kedua - setelah 10- hari ke 14 sakit. Karena serum dapat dicampur secara bersamaan, serum pertama disimpan di lemari es pada suhu -20°C. Paling sering, RTGA, RSK, RNGA digunakan. Reaksi-reaksi ini dilakukan dengan serangkaian diagnostik virus standar khusus (referensi strain virus influenza dari berbagai jenis serologis). Karena serum pasien mungkin mengandung inhibitor hemaglutinasi nonspesifik, serum tersebut pertama-tama dipanaskan pada suhu 56 ° C dan juga diolah dengan enzim khusus (misalnya, neuraminidase) atau larutan kalium periodat, rivanol, mangan klorida, suspensi ban putih, dll. menurut skema khusus. DANReaksi penghambatan hemaglutinasi
Reaksi penghambatan hemaglutinasi dapat dilakukan dalam tabung reaksi (macromsh tod) atau dalam pelat khusus untuk pemeriksaan imunologi.Reaksi dianggap positif bila terbentuk sedimen sel darah merah yang padat dan padat dengan tepi halus.Diagnostik ekspres
Metode ini didasarkan pada identifikasi antigen virus spesifik dalam bahan uji menggunakan imunofluoresensi RIF langsung atau tidak langsung. Lendir diperoleh dari saluran hidung atau dinding belakang faring, disentrifugasi, dan apusan dibuat pada kaca objek dari sedimen sel epitel kolumnar selaput lendir. mereka diobati dengan serum imunofluoresen yang terkonjugasi dengan fluorokrom, misalnya FITC (fluorescein isothiocyanate). Saat memeriksa obat menggunakan mikroskop fluoresen, diamati ciri khas cahaya hijau-kuning dari virus influenza, yang terlokalisasi pada awal penyakit di inti sel epitel.Baru-baru ini, telah diusulkan untuk menggunakan ELISA, RZNGA, dan PCR. untuk menunjukkan antigen virus tertentu.Adsorpsi
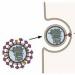
"H5N1" yang terkenal adalah singkatan dari "hemagglutinin tipe lima, neuraminidase tipe satu" - kedua protein ini menonjol di permukaan virus influenza (pada Gambar 1, hemagglutinin berwarna hijau dan neuraminidase berwarna abu-abu).
Dengan bantuan hemagglutinin, virus influenza menempel pada reseptor di permukaan sel. Sasaran awal virus ini adalah sel-sel epitel bersilia pada saluran pernapasan, tetapi ini bukan alasan kita menyukainya: hemaglutinin dapat menempel pada reseptor banyak sel lain, termasuk sel darah merah. Jika satu virus menempel pada dua sel darah merah (yang berdekatan) secara bersamaan, maka sel darah merah tersebut akan saling menempel! Oleh karena itu nama proteinnya - "perekatan darah".
beras. 1
Penerapan
Sel bodoh menyerap virus yang menempel padanya melalui fagositosis - seperti memakannya. Kenapa, kenapa anak-anak selalu memasukkan segala macam hal buruk ke dalam mulutnya?! Namun, virus masih berada di dalam sel sebagai makanan, di dalam vesikel fagositosis (pada Gambar 2 - “endosom”). Endosom bergabung dengan lisosom, vakuola pencernaan terbentuk, proton dipompa ke dalamnya dari sitoplasma untuk menciptakan lingkungan asam (proses ini ditunjukkan pada Gambar 2) - sedikit lagi, dan kita akan mencerna virus (dengan kata “makanan berprotein, apa bedanya”).

beras. 2
Mengupas
Namun virus ini siap menghadapi kejadian berikut:
 beras. 3 |
- Hemaglutinin dimodifikasi di bawah pengaruh lingkungan asam - permukaannya menjadi hidrofilik, dan (sebelumnya melekat pada reseptor di permukaan bagian dalam membran endosom, sekarang) tertanam di dalam membran ini.
- Proton yang dipompa ke dalam endosom melewati protein saluran khusus (protein M2, ditunjukkan pada Gambar 1 dan Gambar 3) melalui cangkang lipid virus dan mencapai cangkang protein virus (pada Gambar 1 - lingkaran bola putih - Protein M1) . Karena itu, cangkang protein dihancurkan (pada Gambar 3, protein M1 dari cangkang protein yang hancur ditandai dengan bintang merah).
- Selubung lipid virus (karena aksi penetrasi hemaglutinin) menyatu dengan membran (lipid) fagosom; RNA virus berakhir di sitoplasma sel.
Replikasi virus
RNA virus yang dilepaskan ke sitoplasma itu sendiri sepenuhnya aman.
- Protein tidak dapat dibuat darinya, karena ia minus RNA (protein tidak dikodekan olehnya, tetapi oleh untai komplementer plus, yang belum ada).
- Juga tidak mungkin membuat RNA darinya - sel kita umumnya tidak memiliki enzim yang mampu menggandakan RNA.
“Oh-ho-ho, kamu tidak punya apa-apa,” gerutu si virus flu sambil menggelengkan kepalanya yang berkumis, “tapi tidak apa-apa, aku membawa semuanya.” Virus ini membawa serta protein PB1, PB2 dan PA, yang bersama-sama membentuk RNA polimerase yang bergantung pada RNA virus - virus ini dapat menduplikasi RNA. Tapi sial! Polimerase apa pun memerlukan primer untuk mulai bekerja, tetapi flu yang pelupa tidak membawanya begitu saja! Semuanya berakhir?!
Tenang, jangan panik! - Dengan kata-kata ini, seluruh kelompok (8 RNA virus dan 3 enzim virus) dikirim ke inti sel. Di sana flu mendapat layanan penuh:
- primer untuk replikasi RNA virus (untuk mendapatkan RNA plus) adalah bagian yang dibelah dari RNA seluler;
- pemrosesan: bagian yang berfungsi sebagai primer untuk sintesis RNA - ini adalah penutup, sehingga modifikasi ujung 5" dilakukan di awal; pada akhir sintesis, poliadelasi ujung 3" terjadi;
- splicing: beberapa RNA virus yang mengandung informasi untuk dua protein dipotong menjadi dua bagian.
Dengan cara ini, RNA plus disintesis, yang dapat berfungsi sebagai cetakan untuk sintesis protein virus dan RNA minus virus.
Maka semuanya menjadi sederhana: sel bodoh, menggunakan ribosomnya sendiri dari asam aminonya sendiri, mensintesis protein virus, termasuk RNA polimerase yang bergantung pada RNA. Influenza tanpa RNA juga diproduksi secara intensif di dalam nukleus. Perakitan partikel virus terjadi di sitoplasma, pada permukaan bagian dalam membran sel. Virus yang sudah selesai meninggalkan sel melalui eksositosis (tunas), neuraminidase menggigit benang terakhir yang menghubungkan sel dan virus yang baru lahir... Kehidupan kecil (jahat) baru muncul ke dunia!

beras. 4
K. SOLTISSEK dan H.-D. KLENK (SN.SCHOLTISSEK, H.-D.KLENK)
I. PENDAHULUAN
Ada sejumlah ulasan mengenai masalah replikasi virus influenza. Literatur sebelum tahun 1968 dirangkum dalam artikel oleh Hoyle (1968) dan Scholtissek (1969); karya yang lebih baru mencakup ulasan oleh White (1973) dan Compans dan Choppin (1974).
Sebagian besar data replikasi diperoleh dari penelitian virus influenza tipe A. Belum ditemukan perbedaan yang signifikan dalam mekanisme replikasi virus influenza jenis lainnya.
Beberapa sistem kultur sel telah tersebar luas yang memudahkan untuk mempelajari replikasi, misalnya perbanyakan virus influenza strain WSN dalam sel MDBK (Choppin, 1969) atau perbanyakan virus wabah unggas (FPV) dalam sel fibroblas embrio ayam. Contoh kurva pertumbuhan virus terakhir dalam satu siklus telah dibuktikan pada tahun 30, dimana masa latennya kurang lebih 3 jam dan produksi virus mencapai titik tertinggi antara 8 dan 12 jam.Secara umum, dalam sistem sel seperti itu, hasil yang tinggi virus menular diamati, dan sintesis protein seluler ditekan dengan sangat efektif setelah infeksi. Oleh karena itu, sistem seperti ini sangat cocok untuk penelitian biokimia.
II. ADSORPSI, PENETRASI, “pengupasan” VIRUS
Infeksi suatu sel dengan virus diawali dengan adsorpsi, yaitu menempelnya partikel virus ke permukaan sel. Untuk perlekatan diperlukan dua struktur yang saling melengkapi, yaitu: tempat reseptor pada permukaan sel dan komponen virus yang bertanggung jawab untuk mengenali tempat reseptor tersebut.Kemampuan virus influenza untuk berinteraksi dengan eritrosit dari berbagai asal dan mengaglutinasinya telah diketahui selama bertahun-tahun. (Hirst, 1941; McClelland, Hare, 1941) Hemaglutinasi telah digunakan sebagai model reaksi interaksi virus influenza dengan permukaan sel, dan “sebagian besar pengetahuan Anda tentang fenomena ini berasal dari penelitian serupa. Namun, kita harus sangat berhati-hati dalam menggeneralisasi, karena struktur permukaan eritrosit dan permukaan sel yang terinfeksi bisa sangat berbeda (lihat juga Bab 3).
A. PERAN HEMAGGLUTIININ DALAM ADSORPSI
Komponen virion yang terlibat dalam pengikatan adalah “lonjakan” HA*. Peran protein β virus dalam permulaan infeksi dipelajari menggunakan antibodi spesifik terhadap dua protein permukaan: HA* dan NA*. Antibodi ini dapat diperoleh dengan menggunakan virus rekombinan. Misalnya, persilangan antara virus AO dan A2 menghasilkan pembentukan X7F1 rekombinan, yang membawa HA*, AO, dan NA* A2 (Kilbourne et al., 1968). Antiserum terhadap virus X7F1 tidak menghambat NA* virus influenza tipe AO, tetapi menghambat hemaglutinasi dan menetralkan infektivitas virus jenis ini. Interaksi serum yang sama dengan virus influenza A2 tidak menghambat hemaglutinasi atau infektivitas, meskipun netralisasi aktivitas NA* telah selesai. Dengan demikian, NA* tidak terlibat dalam proses permulaan infeksi, dan hanya NA* yang tampaknya bertanggung jawab dalam adsorpsi. Konsep ini didukung oleh data bahwa partikel virus yang hanya “paku” neuraminidasenya yang dihilangkan oleh enzim proteolitik tetap menular (Schulze, 1970).
Terdapat bukti bahwa bagian hemaglutinasi terletak di bagian luar “spike” HA*, yang kaya akan karbohidrat (lihat Bab 3). Karbohidrat tampaknya penting untuk fungsi HA*, karena protein HA* yang non-glikosilasi tidak dapat berikatan dengan sel darah merah (Klenk et al., 1972b).
B.RESEPTOR VIRUS FLU
Karbohidrat merupakan komponen penting tidak hanya hemagglutinin, tetapi juga reseptor virus pada permukaan sel.Hirst (1942) mengamati bahwa kompleks virus-eritrosit tidak stabil dan reseptor pada permukaan sel dihancurkan oleh enzim virus. Seperti yang ditunjukkan kemudian, enzim ini adalah neuraminidase, yang memecah asam neurastis dari glikoprotein (Klenk dkk., 1955; Klenk, Stoffel, 1956; Gottschalk, 1957). Ini adalah demonstrasi pertama enzim yang merupakan bagian integral dari partikel virus.Neuraminidase bakteri juga mampu menghancurkan reseptor virus influenza (Burnet, Stone, 1947), sehingga ditemukan bahwa reseptor virus influenza adalah glikoprotein yang mengandung asam neuraminat.
Sejak itu, sejumlah besar informasi telah terkumpul
tentang reseptor myxovirus, dirangkum baru-baru ini dalam sebuah ulasan
Hughes (1973). Data yang diperoleh dirangkum secara singkat sebagai berikut:
hembusan Daerah reseptor mengandung sisa-sisa neuromi-
asam ioat, yang terdapat dalam rantai karbohidrat
glikoprotein. Residu terminal neuromi- yang tidak mengoksidasi
nosnla diperlukan untuk interaksi glikoprotein dengan virus
Flu Rusia. Pengobatan dengan neuraminidase menghilangkan sepenuhnya
aktivitas mengikat. Studi degradasi dengan is
menggunakan periodate diasumsikan untuk penyambungan
aktivitasnya membutuhkan molekul neuramine yang utuh
asam (Suttajit dan Winzler, 1971). gugus karboksil,
mungkin juga memainkan peran penting, karena itu perlu
rupanya, dan gaya elektrostatis (Huang, 1974).
Sepertinya hanya ada bumbu yang lemah
fisik relatif terhadap struktur yang terkait
asam neuraminat, karena telah terbukti utuh
satu set glikoprotein yang mengandung asam jaeuraminic,
berikatan dengan myxovirus. Selain itu, gangliosida (gly-
aktif dalam hal ini (Haywood, 1975).
Masalah pengikatan virus influenza diharapkan menjadi lebih jelas setelah struktur molekul reseptor terbentuk. Sampai batas tertentu, hal ini telah dicapai dalam kasus eritrosit (Marchesi et al., 1973). Informasi tambahan juga dapat diperoleh dengan mempelajari perlekatan myxovirus pada membran buatan (Tiffany dan Blough, 1971).
B. KEMUNGKINAN MEKANISME PENETRASI DAN “STRIPPING”
Dua “mekanisme penetrasi dan “pembukaan” yang berbeda tidak hanya pada virus influenza, tetapi juga virus pada umumnya yang memiliki kulit terluar telah diusulkan. Kedua sudut pandang ini terutama didasarkan pada studi dalam microtrench elektron. Salah satu mekanisme ini adalah vironexis, yang diyakini merupakan proses pnocytosis, ketika partikel virus dimasukkan ke dalam pinosom, yang kemudian bergabung dengan lisosom, dan enzim lisosom menyebabkan virus “terbuka” (Fazekas de St. Grot, 1948). Sudut pandang ini diperoleh dalam karya Dales dan Choppin (1962), dan Dourmashkin dan Tyrrell (1970). Pada 10 menit setelah infeksi, partikel virus terlihat bersentuhan langsung dengan permukaan sel, dan pada 20 menit partikel tersebut terlihat. ditemukan di dalam vakuola sitoplasma. Berbeda dengan penelitian yang dilakukan oleh Morgan dan Rose (1968) yang menyatakan bahwa masuknya virus mungkin disebabkan oleh fusi selubung virus dengan membran sel inang. Oleh karena itu, saat ini belum ada konsensus mengenai mekanisme masuknya virus influenza.
Seperti yang dijelaskan dalam Bab. 5, virion virus influenza mengandung RNA polimerase yang terkait dengan komponen ribonukleoproteinnya. Oleh karena itu, kecil kemungkinannya proses “melepaskan pakaian” dipisahkan secara spasial dari proses pelepasan ribonukleoprotein. Dan tahap ini terjadi pada permukaan sel, sesuai dengan mekanisme membran. fusi, dan dalam vesikel fagositik, sesuai dengan mekanisme virohexis.
AKU AKU AKU. TRANSKRIPSI A. URUTAN SINTESIS RNA
Setelah “menanggalkan pakaian”, sRNA virion harus ditranskripsi menjadi RNA komplementer.RNA polimerase yang dimasukkan bersama partikel penginfeksi harus berfungsi pada tahap pertama perbanyakan virus (lihat Bab 5). Genom virus influenza hanya dapat diisolasi dari virion dalam bentuk
fragmen terpisah (lihat Bab 6). Selain itu, ia berfungsi dalam bentuk fragmen terpisah, seperti yang ditunjukkan oleh analisis genetik (Bab 7) dan inaktivasi bertahap dari virus menular (Scholtissek, Rott, 1964).Dalam hal ini, harus diasumsikan bahwa polimerase memulai sintesis. RNA di setiap fragmen individu Karena RNA tidak ada di dalam sel sebagai molekul bebas, tetapi selalu dibalut dengan protein, timbul pertanyaan: protein apa yang diasosiasikan dengan RNA virus selama replikasinya?
Eksperimen yang dilakukan untuk mempelajari sintesis RNA virus influenza menimbulkan kesulitan besar, karena aktinomisin D tidak dapat digunakan untuk mendeteksi produksi RNA virus ketika secara khusus menekan sintesis RNA seluler, karena antibiotik ini menekan reproduksi virus influenza ( Barry dkk., 1962; Rott, Scholtissek, 1964; Barry dkk., 1965; Pons, 1967). Untuk alasan ini, untuk menentukan urutan waktu sintesis RNA, digunakan hibridisasi spesifik RNA berlabel pulsa di berbagai titik setelah infeksi dengan vRNA atau vcRNA tidak berlabel berlebih, diikuti dengan pengobatan dengan RNase (Scholtissek dan Rott, 1970). Pada tahap awal siklus infeksi, sintesis vcRNA terjadi, mencapai maksimum kira-kira pada jam kedua setelah infeksi, sedangkan pada tahap selanjutnya, sebagian besar RNA spesifik virus yang dihasilkan adalah vRNA. Krug (1972), dengan menggunakan metode berbeda, juga menunjukkan bahwa 4 jam setelah infeksi, sintesis BIKRNA hampir terhenti seluruhnya. Setelah ekstraksi fenol, sejumlah kecil lncRNA terdeteksi (Scholtissek dan Rott, 1970).
Karena fakta bahwa satu atau beberapa jenis RNA virus memiliki informasi1!! berfungsi dan digunakan sebagai cetakan untuk sintesis protein virus (lihat bagian IVA), mungkin terdapat beberapa kontrol translasi pada tingkat katabolisme diferensial RNA virus. Oleh karena itu, eksperimen pulse-chase dilakukan untuk mempelajari stabilitas RNA virus influenza in vivo. Telah ditetapkan bahwa, berbeda dengan RNA seluler, kedua jenis RNA virus sepenuhnya stabil selama periode 90 hari (Scholtissek et al., 1972).
Sebelumnya, ketika mempelajari sintesis RNA virus in vivo, ketika aktinomisin D ditambahkan pada tahap akhir siklus infeksi (Duesberg dan Robinson, 1967; Nayak, 1970; Ma-hy, 1970), mereka tidak memperhitungkan bahwa antibiotik secara spesifik menghambat sintesis RNA komplementer in vivo (Scholtissek dan Rott, 1970; Pons, 1973). Karena lncRNA dilepaskan dari sel yang terinfeksi dalam bentuk setidaknya lima fragmen terpisah, disimpulkan bahwa RNA virus juga disintesis dalam bentuk fragmen (Pons dan Hirst, 1968).
B. LOKALISASI SINTESIS RNA VIRAL DI DALAM SEL HOST
Dari data yang diperoleh melalui autoradiografi, disimpulkan bahwa tempat sintesis RNA virus tampaknya adalah inti sel (Scholtissek et al., 1962; Barry et al., 1974). Karena periode pulsa yang digunakan dalam penelitian ini masih terlalu lama, tidak dapat dikesampingkan bahwa RNA virus disintesis dalam sitoplasma sel dan kemudian diangkut ke nukleus, di mana ia dapat terakumulasi. Selain itu, vRNA dan cRNA dapat disintesis di berbagai tempat di dalam sel.
B. PENGHAMBATAN SINTESIS RNA VIRAL 1. Actimomycin D, mithramycin dan a-amanitin
Ketika aktinomisin D atau mithramycin, yang mengganggu fungsi cetakan DNA, ditambahkan ke sel yang terinfeksi pada saat RNA polimerase yang bergantung pada RNA virus sudah ada (misalnya, 2 jam setelah infeksi), vRNA terus disintesis selama kurang lebih 2 jam lagi. jam.Namun, produksi VcRNA segera berhenti. Kemudian, sintesis vRNA juga menurun, menunjukkan bahwa diperlukan pembentukan vRNA secara terus menerus (Rott et al., 1965; Scholtissek dan Rott, 1970; Scholtissek et al., 1970; Pons, 1973). Gregoriades (1970) menunjukkan bahwa aktinomisin D juga memiliki efek yang kuat pada sintesis vRNA bila ditambahkan pada akhir siklus infeksi. Dalam percobaan ini, sintesis RNA virus ditentukan oleh peningkatan penggabungan uridin berlabel ke dalam total RNA sel yang terinfeksi. Peningkatan ini dapat dihilangkan dengan penambahan aktinomisin D. Namun, harus diingat bahwa infeksi virus influenza menyebabkan peningkatan penggabungan uridin berlabel ke dalam sel setelah infeksi (Scholtissek et al., 1967) dan aktinomisin D. memiliki efek penghambatan pada penggabungan ini (Scholtissek et al., 1967)..., 1969). siAmanitin, yang tidak memiliki afinitas terhadap DNA, mempengaruhi aktivitas salah satu RNA polimerase seluler (RNA podimerase II), dan juga menghambat sintesis cRNA ketika ditambahkan ke cairan kultur segera setelah infeksi (Rott dan Scholtissek, 1970; Mahy et al., 1972).
Mekanisme penghambatan spesifik sintesis cfRNA oleh antibiotik ini tidak sepenuhnya jelas, karena tidak mempengaruhi pembentukan cfRNA secara in vitro. Oleh karena itu, antibiotik ini hanya bekerja secara in vivo, meskipun enzim yang mensintesis cfRNA dapat diisolasi dari sel yang menjadi sasarannya. 2 jam setelah infeksi, aktinomisin D ditambahkan (Scholtissek dan Rott, 1969a).
Reproduksi virus influenza juga dapat ditekan dengan efek lain pada DNA sel inang - pengenalan mitomcin C, perlakuan awal dengan iradiasi ultraviolet, atau penghilangan inti sel sebelum infeksi (Barry, 1964; Rott et al., 1965; Nayak, Rasmussen, 1966; Fol-Lett dkk., 1974; Kelly dkk., 1974). Mekanisme dimana efek ini mempengaruhi replikasi virus influenza mungkin sama dengan mekanisme kerja antibiotik lainnya.Satu-satunya asumsi yang dapat dibuat dari penelitian ini adalah bahwa diperlukan inti sel yang aktif secara "fungsional" dan (atau) dalam fungsi sel yang bergantung pada DNA untuk penyebaran virus influenza. Tidak mungkin untuk mengatakan apa saja fungsi-fungsi ini.
2. Sikloheksimid
Bila sikloheksimid yang secara spesifik menghambat sintesis protein pada sel hewan ditambahkan 2 jam setelah infeksi virus influenza, maka pembentukan vRNA segera terhenti, sedangkan pembentukan vRNA masih berlanjut minimal 2 jam (Scholtissek dan Rott, 1970; Pons , 1973). Belum diketahui apakah sintesis berkelanjutan dari protein virus atau seluler yang digunakan sebagai "Kualitas/kofaktor untuk polimerase yang mensintesis vRNA diperlukan, atau apakah beberapa" protein (misalnya, protein NP) diperlukan untuk menstabilkan vRNA yang baru disintesis. atau penekanan sintesis protein virus tertentu menyebabkan pembentukan cRNA secara terus menerus, yang sintesisnya biasanya dimatikan 3 jam setelah infeksi. Penghentian ini mungkin diperlukan untuk memicu sintesis vRNA. Studi dengan mutan yang sensitif terhadap suhu harus menjawab beberapa pertanyaan ini.
Eksperimen yang dilakukan oleh Bean dan Simpson (1973) menunjukkan bahwa transkripsi primer in vivo (sintesis cRNA pada cetakan RNA menggunakan polimerase dari partikel yang menginfeksi) tidak ditekan oleh sikloheksimid, sedangkan aktinomisin D menekan transkripsi sepenuhnya. Dengan demikian, sikloheksimida tidak mempengaruhi aktivitas polimerase in vivo yang diperkenalkan dengan partikel infeksius dan mensintesis cfRNA; namun, ia menekan sintesis polimerase baru yang diperlukan untuk produksi cfRNA.
3. Glukosamin
Glukosamin diketahui menghabiskan kumpulan UTP dalam sel embrio ayam dengan membentuk UTP-]M-asetilglukosamin (Scholtissek, 1971). Ketika larutan Earl yang mengandung glukosa digunakan sebagai media kultur, maka
hanya berpengaruh pada sintesis glikoprotein virus (lihat bagian V). Namun jika glukosa sebagai sumber energi diganti dengan lyruvat atau fukosa, maka penipisan kumpulan UTP oleh gula amino ini terjadi kira-kira 10 kali lebih aktif. Dalam kondisi ini, kumpulan UTP sel inang menjadi pembatas spesifik laju sintesis vRNA, sedangkan sintesis RNA seluler belum terpengaruh (Scholtissek, 1975).Sebagai akibat dari penekanan sintesis RNA virus, pembentukan protein virus juga tidak ada.
Data ini dapat diinterpretasikan dengan dua cara: baik RNA polimerase yang bergantung pada RNA virus memiliki afinitas yang rendah terhadap UTP dibandingkan dengan polimerase yang bergantung pada DNA seluler dan RIC, atau terdapat dua kumpulan UTP yang kurang lebih independen di dalam sel, salah satunya yang dapat " digunakan untuk sintesis RNA virus dan lebih dipengaruhi oleh glukosamin dibandingkan kumpulan lainnya, yang dapat digunakan sebagai substrat oleh RNA polimerase.
D. SINTESIS RNA VIRAL SECARA IN VITRO
Dalam sel yang terinfeksi virus influenza, beberapa peneliti menemukan RNA polimerase yang bergantung pada RNA (Ho, Walters, 1966; Scholtissek, Rott, 1969a; Skehel, Burke, 1969; Ruck et al., 1969; Mahy, Bromley, 1970; Compans, Caliguiri , 1973). Sebagian besar aktivitas enzim ditemukan pada fraksi mikrosomal sel yang terinfeksi. Dalam sistem in vitro, aktivitas ini dihilangkan oleh RNase, namun tidak oleh DNAse. Ini berarti cetakan internalnya adalah RNA- Reaksi memerlukan kehadiran keempat nukleosida trifosfat dan sensitif terhadap aktitin-icin D. Sebagian besar produksi reaksi in vitro memiliki berat molekul relatif rendah. Data dari Horisberger dan Guskey (1973) menunjukkan bahwa ada dua aktivitas enzim berbeda di sitoplasma: yang satu bergantung pada Mg++ dan dihambat oleh konsentrasi garam yang relatif tinggi, yang lainnya bergantung pada Mn++ dan lebih tahan terhadap garam. Aktivitas enzim yang terakhir juga ditemukan di dalam partikel virus (lihat Bab 5).
Hasil yang bertentangan telah diperoleh mengenai produk enzim sitoplasma dalam sistem in vitro. Ruck ■dkk. (1969) melaporkan bahwa di tangan mereka enzim ini mensintesis setidaknya "beberapa RNA tipe virion (14 hingga 19S). Para penulis sampai pada kesimpulan ini ketika menentukan komposisi basa produk dalam sistem in vitro setelah menginkubasi fraksi mikrosomal. dengan keempat nukleosida trifosfat berlabel radioaktivitas spesifik yang diketahui. Namun, data dari studi terdekat
terhadap tetangga asam adenilat, diperoleh pada pekerjaan yang sama menggunakan [(a-32P]ATP, konsisten dengan data analisis tetangga terdekat yang diperoleh Scholtissek (1969), yang menghasilkan kesimpulan bahwa produk dalam sistem in vitro mempunyai struktur vcRNA. Mahy dan Bromley (1970) dalam publikasi aslinya juga menyatakan bahwa beberapa bagian dari produk dalam sistem in vitro yang dihasilkan oleh enzim sitoplasma harus “vRNA.” Namun, baru-baru ini Hastie dan Mahy (1973) dalam analisis tetangga terdekat dan Hibridisasi spesifik mengkonfirmasi pembentukan enzim sitoplasma hampir secara eksklusif dari cRNA, seperti yang pertama kali ditunjukkan oleh Scholtissek (1969). Caliguiri dan Compans (1973) juga mengisolasi RNA polimerase dari sitoplasma sel yang terinfeksi virus influenza, yang mensintesis RNA dalam suatu sistem in vitro tanpa kurang dari 90% di antaranya memiliki urutan basa yang melengkapi hsRNA. Hastie dan Mahy (1973) “menemukan bahwa persentase yang signifikan dari produk dalam sistem in vitro yang disintesis oleh enzim nuklir dengan adanya aktinomisin D adalah tidak dapat melakukan pibridisasi dengan vRNA yang tidak berlabel. Belum jelas jenis RNA apa yang tidak mampu melakukan hibridisasi tersebut. Sangat sedikit RNA yang disintesis dalam kondisi ini yang berhibridisasi dengan aRNA yang tidak berlabel (Scholtissek, data tidak dipublikasikan).
Kinetika penggabungan GTP berlabel ke dalam RNA virus dapat diartikan sebagai indikasi bahwa tidak ada inisiasi ulang sintesis RNA dalam sistem in vitro. Jika sediaan enzim kasar diinkubasi pada konsentrasi garam rendah, hampir semua RNA yang baru disintesis pada awalnya berbentuk untai tunggal. Namun, setelah ekstraksi dengan fenol, "sebagian besar RNA menjadi resisten terhadap RNAase. Fenol mengubah struktur replikasi perantara, yang terdiri dari templat beruntai tunggal dan cRNA yang baru disintesis, disatukan di tempat replikasi oleh molekul polimerase, menjadi a struktur sebagian beruntai ganda (Feix et al., 1967; Oberg, Philipson, 1971). Data mengenai produk enzim virus influenza dalam sistem in vitro dapat diartikan bahwa polimerase tidak hanya memulai dan melanjutkan polimerisasi, namun juga memisahkan rantai yang baru disintesis dari cetakannya. Jika tidak, struktur RNA beruntai ganda akan terbentuk, yang tidak memiliki fungsi biologis (Paffenholz dan Scholtissek, 1973).Jika inkubasi dilakukan pada konsentrasi garam tinggi atau dengan enzim yang dimurnikan, sebagian besar produknya sudah berupa RNA beruntai ganda. sebelum ekstraksi fenol (Schwartz, Scholtissek, 1973).
Sifat RNA polimerase virus influenza untuk mensintesis cfRNA secara eksklusif dalam sistem in vitro telah dieksploitasi.
Hal ini dimaksudkan untuk membangun hubungan genetik dari berbagai strain virus influenza dengan menentukan homologi dalam urutan dasar di antara mereka (Scholtissek, Rott, 1969b; Hobson, Scholtissek, 1970; Anschutz et al., 1972).
IV. SINTESIS PROTEIN VIRAL
A. TERJEMAHAN IN VITRO
Permasalahan mengenai jenis RNA apa—virionik atau komplementer—yang informatif untuk sintesis protein virus masih belum terselesaikan. Hasil yang bertentangan telah diperoleh mengenai jenis RNA spesifik virus yang berasosiasi dengan polisom. Nayak (1970) menemukan sebuah gradien sukrosa di daerah polisomal, terutama vRNA, sementara Pons (1972) mengisolasi secara eksklusif vcRNA dari polisa. Yang terakhir ini dikonfirmasi oleh pengamatan bahwa setelah penambahan aktinomisin D, yang secara istimewa mempengaruhi sintesis vcRNA (lihat bagian III, B, 1), 2 jam setelah infeksi, cfRNA tidak terdeteksi pada polisom sel yang terinfeksi (Pons, 1973).
Dengan menggunakan sistem sintesis protein dari vRNA E. coli dan virus influenza sebagai templat, Siegert dkk (1973) menemukan pembentukan protein NP virus secara in vitro.Protein NP berlabel ini dikarakterisasi dengan pengendapan gel menggunakan uji Ouchterlony. , Kingsbury dan Webster (1973) tidak mengamati adanya sintesis protein virus dengan vRNA menggunakan sistem sintesis protein yang berasal dari retikulosit kelinci. Namun, dalam sistem yang sama, mereka mendeteksi sintesis protein M virus (om. Bab 2) pada RNA templat yang diisolasi dari sel yang terinfeksi. Dengan demikian, saat ini tidak mungkin untuk menjawab pertanyaan apakah hanya viriopik atau hanya komplementer, atau apakah beberapa fragmen RNA dari satu jenis dan beberapa fragmen RNA dari jenis lain digunakan sebagai templat untuk sintesis protein. Oleh karena itu, untuk saat ini, sulit bagi virus influenza untuk menerapkan definisi rantai virus “negatif” atau “positif”, seperti yang dikemukakan oleh Baltimore (1971).
B. SINTESIS PROTEIN VIRAL DI VIVO
Studi tentang sintesis “protein” virus difasilitasi oleh fakta bahwa dalam sel yang terinfeksi, sintesis polipeptida sel digantikan oleh sintesis spesifik virus. Pada sel fibroblas embrio ayam yang terinfeksi HPV (Joss et al., 1969; Skehel, 1972; Klenk, Rott, 1973), dan pada sel BHK 2IF yang terinfeksi virus influenza strain WSN (Lasarowitz et al., 1971), untuk Hampir 4 jam setelah infeksi disintesis
hanya protein virus (31). Sebelumnya, para peneliti mengamati sintesis tiga atau empat polipeptida pada kutu yang terinfeksi (Taylor et al., 1969; Joss et al., 1969; Holland, Kiehn, 1970; White et al., 1970). Selanjutnya, polipeptida lain ditemukan (Lazorowitz et al., 1971; Skehel, 1972; Klenk et al., 1972b; Krug, Etkind, 1973). Secara umum, semua protein β struktural terdeteksi dalam sel yang terinfeksi: satu atau dua protein P, subunit nukleokapoid NP, protein membran M, hemagglutinium glikoprotein dalam bentuk tidak terpecah (HA) dan terpecah (HA1 dan HA2), dan subunit NA .
Selain protein virion, satu atau dua protein nonstruktural (NS) telah dijelaskan.
Terdapat perbedaan yang mencolok<в уровнях синтеза отдельных вирусных полипептидов. NP- и NS-полипептиды обычно первыми обнаруживаются в зараженных «летках. Skehel (1973) предположил, что полипептиды Р2, NP и NS, которые первыми обнаруживаются в «клетках, зараженных ВЧП, являются
produk fragmen RNA yang terbentuk selama transkripsi selektif oleh virion polimerase dari tiga fragmen genom virus. Ketika sel terinfeksi dengan adanya sikloheksimida dan tag denyut ditambahkan setelah antibiotik dihilangkan, hanya ketiga polipeptida ini yang terdeteksi. Berdasarkan hal ini, diasumsikan bahwa molekul RNA untuk komponen ini dibentuk menggunakan virion lolimerase yang dimasukkan selama transkripsi primer. Dari jam ke 4 sampai jam ke 6 setelah infeksi fibroblas ayam dengan HPV, tingkat sintesis protein M meningkat, dan sintesis NS-lolileptide menurun (Skehel, 1972, 1973). Dengan demikian, tingkat sintesis iolipeptida dapat dikontrol secara individual dan dapat bervariasi selama siklus pertumbuhan.
Selain pembelahan polipeptida HA menjadi HA1 dan HA2, tidak ada bukti bahwa polipeptida virus influenza spesifik virus diperoleh sebagai hasil pembelahan prekursor besar (Taylor et al., 1969; Lazarowitz et al., 1971, Skehel , 1972; Klenk, Rott, 1973).
Baru-baru ini, informasi baru telah diperoleh mengenai lokalisasi komponen virus dalam sel yang terinfeksi menggunakan autoradiografi (Becht, 1971) atau teknik fraksinasi sel dan elektroforesis gel (Taylor et al., 1969, 1970). Menurut penelitian ini, sintesis semua protein virus tampaknya terjadi di sitoplasma. Studi sebelumnya tentang lokalisasi antigen nukleotida oleh imunofluoresensi ditafsirkan sebagai indikasi bahwa sintesis terjadi di dalam nukleus dengan pelepasan antigen berikutnya ke dalam sitoplasma (Liu, 1955; Breitenfeld dan Schafer, 1957; Holtermann et al., 1960). Namun, jelas bahwa imunofluoresensi menentukan akumulasi antigen, dan bukan sintesisnya (lihat bagian IV, B, 2).
1. RNA polimerase
Aktivitas spesifik virus dari RNA polimerase yang bergantung pada RNA dapat dideteksi dalam sel yang terinfeksi virus influenza antara 13 dan 3 jam setelah infeksi, tergantung pada sistem sel yang digunakan (Scholtissek dan Rott, 1969a; Skehel dan Burke, 1969; Ruck et al. al., 1969; Mahy, Bromley, 1970). Ini adalah aktivitas spesifik virus pertama yang terdeteksi setelah infeksi. Sebagian besar aktivitas virus lolimerase terdeteksi pada fraksi mikrosomal; beberapa bagian dari aktivitas ini tetap berada di dalam inti dan tidak dapat dihilangkan bahkan dengan pencucian intensif. Tidak ada perbedaan mendasar dalam kinetika manifestasi atau kofaktor yang diperlukan antara enzim nuklir dan mikrosomal (Scholtissek dan Rott, 1969a; Mahy et al., 1975).
Setelah fraksinasi lebih lanjut dari sitoplasma dalam gradien sukrosa bertahap menggunakan metode Caliguiri dan Tamm (1970), aktivitas polimerase terdeteksi dalam membran kasar (Compans dan Caliguiri, 1973; Klenk et al., 1974a).
Karena aktivitas polimerase virus telah terdeteksi pada partikel virus yang dimurnikan (lihat Bab 5), timbul pertanyaan mengenai protein virus mana yang mungkin terkait.Polimerase yang diisolasi dari sel yang terinfeksi virus influenza dimurnikan sekitar 200 kali lipat. Satu-satunya produk spesifik virus yang terkait dengan aktivitas polimerase adalah antigen RNP (protein NP ditambah vRNA virus, ditentukan dengan metode fiksasi komplemen). Semua upaya untuk menghilangkan RNA dari kompleks ini mengakibatkan hilangnya aktivitas enzim (Schwarz dan Scholtissek, 1973). Protein P dikemukakan sebagai kandidat untuk peran virus polimerase (Kilbourne et al., 1972). Ketika kompleks enzimatik, yang diberi label asam amino in vivo, diisolasi dari sel yang terinfeksi virus influenza dan dimurnikan sekitar 35 kali lipat, analisis elektroforesis pada awalnya hanya mengungkapkan HP-beloa dalam kompleks ini.< (Compans, Caliguiri, 1973). Впоследствии, однако, при других условиях введения;метки удалось обнаружить и Р-белок (Caliguiri, Compans, 1974). С другой стороны, Klenk и соавт. (1974) обнаружили Р-белок в цитоплазматическом золе, "который не обладает полимеразной активностью (Scholtissek, Rott, 1969a; Skehel, Burke, 1969). Эти наблюдения могут означать, что Р-белок осуществляет свою (Предполагаемую активность ферментов только при связывании с РНП-антигеном.
Antigen RNP itu sendiri tidak mungkin mempunyai aktivitas polimerase, karena serum hiperimun terhadap antigen RNP tidak menghambat aktivitas polimerase, sedangkan serum konvalesen, yang mungkin mengandung antibodi terhadap polimerase, menghambat aktivitas polimerase (Scholtissek et al., 1971). Serum konvalesen ini (yang diperoleh dari hewan yang terinfeksi virus influenza A) menghambat aktivitas polimerase semua strain virus influenza A yang diteliti, namun tidak menghambat aktivitas polimerase virus influenza B. Semua pengamatan ini konsisten dengan gagasan bahwa RNP- antigen (BPHK + NP = protein), dapat berfungsi sebagai cetakan untuk sintesis cRNA-
2. Protein nukleokapsid
Protein NP berikatan dengan RNA virus, membentuk antigen RNP. Hal ini berlaku untuk protein NP yang diisolasi tidak hanya dari virion, tetapi juga dari sel yang terinfeksi (Schafer, 1957). cara serologis, kapan
kira-kira 3 jam setelah infeksi, satu jam sebelum munculnya hemaglutinin (Breitenfeld, Schafer, 1957). Setelah itu, titer antigen RNP tidak meningkat secara signifikan. Hal ini mungkin terjadi karena keseimbangan antara sintesis baru dan penggabungan menjadi partikel dewasa. Dengan memberi label, protein NP “dapat dideteksi dalam sel yang terinfeksi dalam waktu 2 jam setelah infeksi (Scholtissek dan Rott, 1961; Krug, 1972).
Dengan bantuan antibodi fluoresen, antigen RNP pertama kali terdeteksi di dalam inti. Kemudian muncul di sitoplasma (Breitenfeld dan Schafer, 1957). Dalam kondisi tertentu, seperti infeksi yang gagal (Franklin, Brietenfeld, 1959), dengan adanya p-fluorophenylalanine (Zimmermann, Schafer, 1960), atau dalam kondisi fenomena von Magnus (Rott, Scholtissek, 1963), RNP -antigen tetap berada di dalam inti.
Akumulasi awal antigen RNP dalam inti sel yang terinfeksi tidak berarti bahwa protein NP juga disintesis di dalam inti. Studi autoradiografi, serta penggunaan metode fraksinasi sel, menunjukkan sintesis sitoplasma dari protein ini dan protein lain yang kaya arginin dan transpor cepatnya dari sitoplasma ke inti (Taylor et al., 1969, 1970; Becht, 1971).
Dalam ekstrak sel yang terinfeksi, sebagian kecil antigen RNP mengandung vRNA (Pons, 1971; Krug, 1972; Krug, Etkind, 1973), meskipun hanya satu jenis RNA yang ditemukan dalam partikel virus (yang disebabkan oleh tidak adanya hibridisasi diri vRNA) (Scholtissek, Rott, 1971; Pons, 1971). Tidak mungkin untuk memutuskan apakah antigen RNP yang mengandung cfRNA memiliki peran spesifik dalam proses perbanyakan virus atau hanya artefak yang muncul selama proses fraksinasi seluler. Telah ditunjukkan bahwa kedua untai RNA berikatan sama baik dengan protein NP secara in vitro (Scholtissek dan Becht, 1971). Jadi, jika terdapat protein NP bebas dan cRNA bebas, antigen RNP yang sesuai segera terbentuk selama proses homogenisasi. Virion RNA dapat digantikan dari antigen RNP oleh polivin "Ilsulfate" M (Pons et al., 1969). Oleh karena itu, dapat diuji apakah penggantian RNA virus yang berbeda dalam antigen RNP dapat dilakukan dalam homogenat seluler. Dari perubahan komposisi dasar RNA virus yang diberi label 32P selama berbagai periode waktu dan diisolasi dari antigen RNP sitoplasma, Krug (1972) menyimpulkan bahwa beberapa cfRNA, sebelum dimasukkan ke dalam antigen RNP, ada dalam bentuk bebas. dari NP- tupai. Penggabungan 32P ke dalam RNA vesikel hewan terjadi dengan fase jeda yang signifikan karena penggabungan fosfor berlabel yang agak lambat ke dalam posisi x nukleosida trifosfat (Scholtissek, 1965). Sampai penyesuaian yang tepat dilakukan untuk perhitungan perubahan komposisi
tidak ada dasar yang dibuat, data Krug (1972) harus ditafsirkan dengan hati-hati.
Analisis kinetik terhadap “kemunculan antigen RNP dalam inti dan sitoplasma” yang dilakukan oleh Krug (1972) menunjukkan bahwa antigen RNP yang terakumulasi dalam inti bukanlah prekursor antigen RNP yang ditemukan dalam sitoplasma.
3. Protein non-struktural
Beberapa protein spesifik virus nonstruktural yang fungsinya tidak diketahui telah dijelaskan untuk sel yang terinfeksi. Salah satunya, dengan berat molekul relatif 25.000, yang terakumulasi dalam jumlah besar, disebut NS (Lazarowitz et al., 1971). Dalam gel poliakrilamida, ia memiliki tingkat migrasi yang mendekati mobilitas protein M. Namun, kedua protein tersebut, tampaknya independen satu sama lain, seperti terlihat dari perbedaan peta peptidanya.Sejumlah besar protein NS ditemukan di dalam inti (Lazarowitz et al., 1971; Krug, Etkind, 1973). konsisten dengan data studi imunofluoresensi sebelumnya oleh Dim-mock (1969), yang mengamati "pewarnaan cerah pada inti dengan antiserum spesifik untuk antigen virus non-struktural, dan pewarnaan ini mungkin mencerminkan keberadaan protein NS. Protein ini juga ditemukan menjadi protein spesifik virus utama dalam fraksi ribosom bebas dan terikat membran yang diisolasi dari sel yang terinfeksi (Pons, 1972; Compans, 1973; Klenk et al., 1974a). Asosiasi NS dengan ribosom tampaknya bergantung pada kekuatan nada (Krug dan Etkind, 1973). Dalam buffer dengan kekuatan ionik rendah, nolipaptida INI diadsorpsi pada kedua subunit ribosom, sedangkan ketika garam ditambahkan, nolipaptida ini dihilangkan dari subunit tersebut.
Sebuah penelitian baru-baru ini (Gregoriades, 1973) menimbulkan keraguan pada identifikasi NS sebagai polipeptida non-struktural yang berbeda dari polipeptida virion M. Polipeptida M dari virion dapat diekstraksi dengan kloroformmetanol asam, dan protein. dengan mobilitas elektroforesis yang identik juga dapat diekstraksi dari seluruh sel yang terinfeksi, -nukleus atau polisom.Analisis produk pemrosesan tryptic dari protein M, serta protein terkait inti dan ribosom, menghasilkan banyak kecocokan, menunjukkan bahwa M dan Protein NS identik, namun diperlukan informasi lebih lanjut untuk memberikan penjelasan yang meyakinkan atas hasil ini.
Selain NS, mungkin ada komponen spesifik virus non-struktural lainnya, meskipun tidak ada satupun. belum cukup dikarakterisasi. Menggunakan antiserum yang ditujukan terhadap antigen virus non-struktural,
Dimmock dan Watson (1969) mengendapkan polipeptida berlabel radiolabel dari sel yang terinfeksi. Analisis elektroforesis pada gel poliakrilamida menunjukkan adanya beberapa polipeptida non-struktural dengan komponen utama yang berhubungan dengan NS. Salah satu komponen nonstruktural yang tersisa bermigrasi lebih cepat dan mungkin sesuai dengan komponen berat molekul relatif 10.000 hingga 15.000 yang dijelaskan oleh Skehel (1972) dan Krug dan Etkind (1973).
4. Protein membran M
Protein M, yang "melapisi permukaan bagian dalam lapisan ganda lipid selubung dan kaya akan virion, ditemukan dalam jumlah yang relatif kecil pada sel yang terinfeksi. Hal ini menunjukkan tidak hanya pengendalian sintesis protein M, tetapi juga kemungkinan bahwa sintesis ini merupakan tahap yang membatasi laju reproduksi virus (Lazarowitz et al., 1971) Konsep ini didukung oleh data bahwa pada suhu 29°C, di mana produksi virus ditekan, protein M adalah hanya protein spesifik virus yang tidak dapat dideteksi pada sel yang terinfeksi (Klenk, Rott, 1973).
Protein M (dapat ditemukan pada membran halus dan plasma sel yang terinfeksi (Lazarowitz et al., 1971; Cornpans, 1973a; Klenk et al., 1974a). Data ini menunjukkan afinitas protein ini terhadap membran.
5. Hemaglutinin
Hemagglutinin disintesis sebagai glikoprotein besar - prekursor HA, yang kemudian dipecah menjadi dua glikoprotein yang lebih kecil: HAi dan HA2 "(Lazarowitz et al., 1971). Pembelahan, yang dapat ditekan oleh protease inhibitor (Klenk, Rott, 1973 ), dilakukan tampaknya oleh enzim proteolitik sel inang (Lazarowitz et al., 1973). Derajat pembelahan tergantung pada strain virus, sel inang, tingkat efek sitotoksik dan ada tidaknya virus. serum dalam medium (Lazarowitz et al., 1971, 1973a, b ; Klenk, Rott, 1973; Stanley et al., 1973). Jadi, WSN yang ditanam dalam kultur fibroblas embrio ayam hanya mengandung protein glish hemagglutnin yang dibelah, sedangkan pembelahan hampir tidak ada jika virion WSN ditumbuhkan dalam sel MDBK tanpa adanya serum. Namun, dengan adanya serum, hemagglutinin WSN juga dibelah.
sistem berlangsung pada membran plasma (Lazaro-witz et al., 1973a). Pada sistem VChP, mekanisme pemisahan tersebut ternyata berbeda. Pembelahan “terjadi pada membran intraseluler, dan plasminogen dalam kasus ini tidak diperlukan (Shchepk et al., 1974a). Derajat pemisahan menurun tajam pada suhu 25 °C (Klenk dan Rott, 1973).
Pembelahan HA bukanlah persyaratan untuk aktivitas hemaglutinasi atau perakitan virion (La-zarowitz et al., 1973a; Stanley et al., 1973), namun penelitian terbaru menemukan bahwa hal ini diperlukan untuk infektivitas (Klenk et al., 1975b). Data ini konsisten dengan hipotesis bahwa, selain perannya dalam adsorpsi, HA* mempunyai fungsi lain dalam proses infeksi dan degradasi diperlukan untuk fungsi ini. Atas dasar itu degradasi HA merupakan fenomena yang bergantung pada "sel inang". , dan bahwa partikel yang mengandung HA yang tidak terpecah memiliki tingkat infektivitas yang rendah, menunjukkan bahwa jangkauan inang dan penyebaran infeksi virus influenza bergantung pada keberadaan protease sel inang sebagai enzim pengaktif.
Dalam percobaan fraksinasi “letlet yang terinfeksi vi
Rus influenza, ditemukan bahwa glikoprotein HA selalu
berhubungan dengan membran (Compans, 1973a; Klenk et al.,.
1974a). Lokalisasi intraseluler dari protein ini dan momennya
walkie-talkie dari membran kasar ke membran endoplasma halus
retikulum langit dan ke membran plasma akan de
dijelaskan secara rinci di bagian VII, B. .,
6. Neuraminidase
Viral NA* sebagai enzim aktif ditemukan
3 jam setelah infeksi pada membran alantois korionik
nakh, dan dengan ekstrapolasi ditetapkan bahwa awal synnya
tesis terjadi 1-2 jam setelah infeksi (Noll et al.,
1961). Lokalisasi NA* intraseluler dipelajari menggunakan
kemudian fraksinasi sel, dan ternyata dia
mu, mirip dengan lokalisasi HA* (Compans, 1973a; Klenk et al.,
1974a). NA* ditemukan berasosiasi dengan membran,
diperoleh dari retikulum endoplasma halus,
ketika menentukannya dengan aktivitas biologis dan analisis
zu dalam gel poliazhrilamide. Aktivitas enzim tinggi
dena juga dalam fraksi yang mengandung membran kasar
kita. Data ini konsisten dengan data yang diperoleh dari
imunofluoresensi (Maeno, Kilbourne, 1970). Setelah 4 jam
setelah infeksi, neuraminidase dapat dideteksi di sitoplasma
plasma; kemudian dia tampak berkonsentrasi pada peri
sel feria.
V. SINTESIS KARBOHIDRAT
Karbohidrat terlibat dalam pembentukan glikoprotein dan glikolida pada selubung virus influenza (Klenk et al., 1972a). Glikolipid dari myxovirus (berasal dari membran plasma sel inang (Klenk, Choppin, 1970), tetapi belum ditentukan mana yang sebagian besar termasuk dalam virion: glikolipid yang sudah ada atau yang baru disintesis.
Penggunaan prekursor radioaktif seperti glukosamin, manosa, galaktosa dan fukosa, yang secara khusus dimasukkan ke dalam glukopeltida virus, telah menunjukkan bahwa rantai samping karbohidrat dari glikopeptida ini disintesis ulang selama infeksi (Haslam et al., 1970; Cornpans et al., 1970a;Schwarz dan Klenk, 1974). Percobaan fraksionasi sel telah memberikan informasi tambahan tentang lokasi glikosilasi glikoprotein virus.Glukosamin berhubungan dengan polipeptida HA pada fraksi membran sitoplasma halus dan kasar, namun fukosa berhubungan dengan HA pada membran halus namun tidak kasar (Compans, 1973b). .Penekanan sintesis protein oleh puromisin segera menghentikan penggabungan glukosamin, sementara fukosa terus dimasukkan selama sekitar 10-15 menit (Stanley et al., 1973). Akhirnya, dalam FPV, glikoprotein adalah prekursor HA dan pembelahan produk HAj<и НА2 содержат, по-видимому, полный состав маннозы « глюкозамина, тогда как содержание фукозы и галактозы значительно выше в продуктах расщепления (Klenk et al., 1975a; Schwarz, Klenk, 1974). Эта наблюдения предполагают, что биосинтез углеводных боковых целей гликопротеинов НА осуществляется по стадиям с различными остатками Сахаров, добавляемыми в разных участках клетки. Глюкозамин и манноза (присоединяются, по-видимому, к полипептидам НА на шероховатых мембранах вскоре после или даже в процессе синтеза поляпептида, в то время как фукоза, вероятно, прикрепляется позже с помощью трансфераз, присутствующих в гладких мембранах.
Gliksiltransferase ini mungkin merupakan enzim seluler. Akibatnya, karbohidrat (bagian dari glikoprotein tampaknya ditentukan oleh sel inang. Namun terdapat bukti bahwa selain enzim sel inang ini, NA* virus memainkan peran penting dalam pembentukan rantai samping karbohidrat. Telah diketahui bahwa menetapkan bahwa permukaan cangkang myceovirus kekurangan asam neuraminat (Klenk, Choppin, 1970b; Klenk et al., 1970), sedangkan pada cangkang virus yang tidak mengandung enzim ini, karbohidrat tersebut merupakan komponen yang umum (Klenk, Choppin, 1971 ; McSharry, Wagner, 1971 ; Renkonen dkk., 1971) Data ini menunjukkan bahwa
Efek asam neuraminat merupakan ciri penting dari myxovirus. Baru-baru ini ditunjukkan bahwa NA* bertanggung jawab untuk menghilangkan asam neuraminat dari selubung virus influenza, sehingga mencegah pembentukan reseptor pada selubung virus yang sebaliknya akan mengarah pada pembentukan kumpulan besar partikel virus (Palese et al., 1974) .Data ini mendukung konsep bahwa bagian karbohidrat dari NA*, sebagai glikoprotein permukaan utama, merupakan produk dari aksi gabungan (Transeferase seluler dan NA* virus. Berkat aksinya, virus mampu memperkenalkan virus- modifikasi spesifik menjadi (Awalnya, struktur modifikasi karbohidrat kompleks dan spesifik inang, yang menurut -tampaknya penting untuk aktivitas biologis virus.
D-glukosamin dan 2-deoksi-O-glukosa menghambat pembentukan HA*, NA* dan virus menular yang aktif secara biologis (Kilbourne, 1959; Kaluza et al., 1972). Studi biokimia telah mengungkapkan bahwa gula ini bersaing dengan biosintesis glikoprotein virus (Ghandi et al., 1972; Klenk et al., 1972b). Dengan adanya inhibitor ini, ukuran glikoprotein NA berkurang. Derajat penurunannya bergantung pada dosis. Jadi, dengan peningkatan konsentrasi gula, glikoprotein NA dengan berat molekul relatif 76.000 secara bertahap berubah menjadi senyawa dengan a berat molekul 64.000, yang ditetapkan sebagai HA0 (Klenk et al., 1972b; Schwarz dan Klenk, 1974). Pergeseran berat molekul sejajar dengan penurunan kandungan karbohidrat dan protein HA0 ditemukan hampir bebas karbohidrat (Schwarz dan Klenk, 1974). Hasil ini menunjukkan bahwa HA0 adalah rantai polipeptida HA yang terglikosilasi tidak lengkap atau "eglikosilasi" dan bahwa efek penghambatan D-glukosa amina a dan 2-deoksi-O-glukosa disebabkan oleh kerusakan glikosilasi. Polipeptida HA0 terikat pada membran, seperti HA biasa. Ia juga bermigrasi dari retikulum kasar ke retikulum halus, di mana ia dipecah menjadi polipeptida HA01 dan HA02. Oleh karena itu, karbohidrat mungkin tidak penting untuk afinitas polipeptida ini terhadap membran. Namun, tidak adanya aktivitas hemaglutinasi pada sel yang terinfeksi menunjukkan bahwa protein non-glikosilasi tidak mampu berikatan dengan reseptor.
VI. SINTESIS LIPID
Seperti semua virus yang berselubung, virus influenza memperoleh lipidnya dengan mendaur ulang lipid sel inang. Posisi ini ditegaskan oleh pengamatan berikut:
penolakan. Komposisi lipid virus influenza ditemukan serupa dengan sel inang (Ambruster dan Beiss, 1958; Frommhagen et al., 1959). Lipid sel inang, yang diberi label radioaktif sebelum infeksi, dimasukkan ke dalam partikel virus (Wecker, 1957). Ketika virus ditumbuhkan di berbagai sel inang, modifikasi lipid virus terdeteksi (Kates et al., 1961, 1962). Secara umum, lipid virus (yang bertunas dari permukaan sel, sangat mencerminkan komposisi lipid membran plasma sel inang (Klenk, Choppin, 1969; 1970a, b; Renko-nen et al., 1971). tingkat sintesis de novo f-ospholylides dalam sel fibroblas embrio ayam tetap tidak berubah selama 7 jam setelah infeksi virus influenza, setelah itu semua sintesis lipid ditekan (Blough et al., 1973). Penekanan ini mungkin bukan merupakan efek utama, namun mungkin menjadi hal sekunder dalam kaitannya dengan penghambatan sintesis RNA atau protein atau “efek biologis lainnya.
Jadi, berdasarkan hasil yang diperoleh sampai saat ini, dapat diasumsikan bahwa sintesis lipid virus terjadi melalui proses biosintesis lipid seluler normal, dan selubung virus dibentuk oleh penggabungan lipid dari membran plasma sel inang.
VII. PERAKITAN (lihat juga Bab 2)
A. PEMBENTUKAN NUKLEOCAPSIDA
Seperti yang telah disebutkan, kemungkinan besar protein nukleokapsid disintesis di sitoplasma. Rupanya, ia hadir di sana untuk waktu yang singkat dalam bentuk bebas, dan kemudian berasosiasi dengan RNA virus, membentuk nukleokapsid (Klenk et al., 1974; Compans dan Caliguiri, 1973). Karena protein NP dengan cepat dimasukkan ke dalam yaucleocapsids, RNA dapat dipilih dari kumpulan yang telah direformasi (Krug, 1972). Karena ukuran nukleokapsid virus influenza yang kecil, mereka tidak dapat diidentifikasi secara akurat dalam sel yang terinfeksi menggunakan mikroskop elektron. Kelompok filamen atau serat dengan diameter sekitar 5 nm yang diamati dalam sitoplasma mungkin mewakili ribonukleoprotein virus (Apostolov et al., 1970; Compans et al., 1970b).
Data yang tersedia menunjukkan bahwa genom RNA virion virus influenza terdiri dari 5-7 fragmen (lihat Bab 6).
Oleh karena itu, setiap partikel menular memerlukan setidaknya satu salinan dari setiap fragmen. Hirst (1962) sebelum
mengemukakan bahwa nukleokapsid dari kumpulan intraseluler dapat dimasukkan ke dalam (virion secara acak. Proporsi virion menular dalam populasi E dapat ditingkatkan dengan memasukkan fragmen RNA tambahan ke dalam virion rata-rata (Compans et al., 1970). Misalnya, jika lima diperlukan untuk menularkan fragmen RNA yang berbeda, setiap virnoy berisi total 7 fragmen yang dimasukkan ke dalam virnoy secara acak, maka sekitar 22% dari virion harus menular. Bukti masuknya fragmen RNA secara acak diperkuat oleh pengamatan Hirst baru-baru ini ( 1973) bahwa dalam suatu populasi virus, terjadi rekombinasi antar partikel yang tidak membentuk plak. Kemampuan partikel tersebut untuk ikut serta dalam rekombinasi dapat dijelaskan dengan tidak adanya satu atau lebih fragmen dalam partikel, dengan fragmen yang hilang bervariasi dari satu partikel. ke yang lain, sehingga partikel virus yang cacat dapat membentuk rekombinan.
B. PROSES BUNDING VIRUS
Seperti kebanyakan virus yang berselubung, virus influenza berkumpul pada membran sel yang telah terbentuk sebelumnya; perakitan terjadi dengan tunas dari membran plasma. Demonstrasi pertama pelepasan virus dari sel melalui proses yang tidak melibatkan lisis dilakukan oleh Murphy dan Bang (1952) dalam studi mikroskop elektron awal pada sel yang terinfeksi virus influenza.Struktur berserabut dan berbentuk bola. Partikel virus tidak terlihat di dalam sel selama pembentukan virus menular dan oleh karena itu jelas bahwa partikel virus terbentuk di permukaan sel. Dengan menggunakan antibodi berlabel feritin, Morgan dkk (1961) mengamati bahwa permukaan sel mengandung virus antigen di daerah di mana virus terbentuk. Penelitian mikroskopis elektron selanjutnya menunjukkan bahwa permukaan virus yang sedang bertunas mengandung membran yang sama dengan sel inang dengan lapisan proyeksi yang sesuai dengan “paku” virus di permukaan luar. Pada permukaan membran virus terdapat lapisan padat elektron tambahan yang tidak ada pada permukaan sel, yang mungkin terdiri dari M-olipeptida (Bachi et al., 1969; Compans, Dimmock, 1969; Apostolov et al., 1970).
Studi mikroskop elektron telah memberikan dasar untuk ■menyarankan urutan komponen virus dalam senyawa tersebut.
berasosiasi pada membran sel (Bachi et al., 1961; Compans dan Dimmock, 1969; Compans et al., 1970b).
Protein selubung virus muncul pertama kali, dimasukkan ke dalam beberapa area membran yang seharusnya memiliki morfologi normal; namun, adsorpsi spesifik eritrosit yang diamati pada area membran ini menunjukkan adanya protein HA di sini. Kemudian, rupanya, protein M berasosiasi dengan permukaan bagian dalam area membran tersebut, membentuk lapisan padat elektron.Selanjutnya, ribonukleoprotein secara spesifik berikatan dengan membran di area tersebut dan proses pertunasan terjadi dengan membengkokkan dan menonjolkan membran. segmen dan mengelilingi ribonukleoprotein terkait. Data elektroforesis gel poliakrilamida juga mendukung gagasan bahwa protein selubung berasosiasi dengan membran plasma lebih cepat dibandingkan RNP (Lazarowitz et al., 1971). Polipeptida sel inang dipindahkan dari membran, yang merupakan prekursor untuk dalam selubung virus, karena polipeptida tersebut tidak ditemukan dalam virion yang dimurnikan. Seperti telah disebutkan, residu asam neuraminat tidak ada dalam selubung partikel virus influenza yang sedang berkembang, tetapi terdapat di area yang berdekatan pada membran sel (Klenk et al., 1970) .
Data ini memberikan bukti transisi dramatis dalam komposisi kimia antara selubung partikel virus yang sedang berkembang dan membran sel yang berdekatan.
Namun, di sisi lain, ciri penting dari proses pertunasan adalah bahwa selubung virus bersambung dengan membran plasma sel inang dan secara morfologi mirip dengannya (Compans dan Dimmock, 1969). Seperti disebutkan, lipid dalam membran ini memiliki kemiripan yang sangat dekat dengan lipid pada membran sel inang. Pengamatan ini menunjukkan bahwa lipid dalam membran plasma utuh mudah bertukar dengan lipid dalam partikel virus yang sedang berkembang melalui difusi radial.
Akibatnya, selubung virion yang sedang tumbuh terbentuk dari sebagian kecil membran sel yang dimodifikasi dengan masuknya protein selubung virion. Konsep ini, tentu saja, tidak menyiratkan perlunya sintesis seluruh komponen selubung pada membran plasma.
Memang, telah diketahui sejak lama bahwa unsur-unsur penyusun membran harus bermigrasi dalam jarak yang cukup jauh dari satu bagian sel ke bagian sel lainnya agar dapat berpindah dari tempat biosintesisnya ke tempat perakitan membran. Breitenield dan Schafer (1957) menunjukkan bahwa pada sel yang terinfeksi virus influenza, HA* pertama kali terlihat
terjadi di seluruh bagian sel dan terlokalisasi di zona perinuklear dengan konsentrasi yang meningkat. Kemudian, HA* terakumulasi di "daerah perifer" suar dan juga dapat terlihat pada benang tipis yang menonjol dari membran suar.
Gagasan bahwa komponen selubung bermigrasi dari dalam sel ke permukaan baru-baru ini dikonfirmasi dan diperluas melalui serangkaian penelitian yang menggunakan fraksinasi sel dan analisis protein virus dalam fraksi sel yang berbeda. Studi-studi ini juga menunjukkan bahwa glikoprotein HA, dan mungkin protein selubung lainnya, disintesis pada retikulum endoplasma kasar (Compans, 1973a; Klenk et al., 1974). Seperti yang terungkap dalam eksperimen pengejaran denyut nadi, setelah beberapa menit HA ditemukan di membran retikulum endoplasma halus (Compans, 1973a; Stanley et al., 1973; Klenk et al., 1974) dan di membran plasma (Stanley et al., 1973; Klenk et al., 1974) dan di membran plasma (Stanley et al., 1974) al., 1974).., 1973). Meskipun percobaan pengejaran dari retikulum endoplasma halus ke membran plasma belum pernah dilakukan, tampaknya masuk akal bahwa HA bermigrasi dari retikulum endoplasma kasar ke membran plasma, melewati retikulum endoplasma halus. Perlu dicatat bahwa selama migrasi tersebut, HA dan protein membran lainnya merupakan bagian integral dari membran tempat mereka bergerak; OBI tidak pernah ditemukan sebagai protein terlarut.
Dalam fraksi membran halus, yang diyakini berasal terutama dari retikulum endoplasma, semua protein selubung utama ditemukan (Compans 1973a; Klenk et al., 1974). Namun, jumlah relatifnya di sini berbeda dengan jumlah di membran plasma dan virion (Stanley et al., 1973; Klenk et al., 1974). Rasio protein M terhadap glikoprotein HA lebih tinggi pada selubung virion matang dibandingkan pada membran retikulum endoplasma. Data ini menunjukkan bahwa hanya sejumlah kecil membran yang membawa glikoprotein HA yang diubah menjadi selubung virus, yaitu fraksi membran yang mengandung protein bebas karbohidrat. Seperti yang telah ditunjukkan, sintesis protein M mungkin merupakan tahap yang membatasi proses perakitan virus.
Perbedaan laju sintesis protein selubung yang berbeda mendukung hipotesis bahwa perakitan selubung merupakan proses multitahap.Konsep ini konsisten dengan pertanyaan tentang proses pembentukan HA*, termasuk penambahan berurutan bagian karbohidrat dan pembelahan proteolitik selama migrasi produk gen primer.
VIII. PEMBEBASAN VIRUS FLU
Masalah pelepasan virus influenza dari sel inang,
tampaknya berkaitan erat dengan masalah fungsi virus
NA*, yang telah dibahas secara rinci sebelumnya (lihat
kasus V dan bab. 4). Fakta bahwa enzim ini memainkan peran penting
Peran dalam pelepasan virus, berasal dari kemampuan anti
badan khusus untuk NA* menekan pelepasan tersebut (Se-
untuk, Rott, 1966; Webster dkk. G968). Apalagi antibodi tersebut
mencegah elusi virus dari eritrosit (Brown, Laver,
1968). Bakteri NA*, yang tidak dihambat oleh antibodi
lami menjadi virus NA*, mampu melepaskan virus dari sel,
diobati dengan antibodi tersebut (Compans et al., 1969;
Webster, 1970). Di sisi lain, antibodi divalen
ke NA juga menyebabkan agregasi virus (Seto dan Chang, 1969;
Perusahaan dkk., 1969; Webster, 1970), dan anti monovalen
Tubuh tidak mencegah pelepasan virus, meski menghambat
lebih dari 90% aktivitas neuraminidase (Becht et al., 1971).
Semua data yang dikumpulkan menunjukkan hal itu
antibodi divalen mengganggu pelepasan virus
dengan mengikatnya ke antigen yang ada pada
permukaan sel, dan dengan menghambat aktivitas enzim
polisi. Peran neuraminidase dalam pelepasan virus tampilan
atau Palese dkk. (G974), yang menetapkan bahwa fer ini
ment diperlukan untuk menghilangkan asam neuroamylic dari vi
permukaan Rusia untuk menghindari agregasi virion - nanti -
kov pada permukaan sel.
IX. BENTUK REPRODUKSI YANG TIDAK NORMAL
A. REPRODUKSI ABORTIF TERGANTUNG PADA SEL HOST
Virus influenza dapat menginfeksi berbagai macam sel inang. Namun, pada banyak sel yang terinfeksi, hasil keturunan yang menular sangat rendah atau tidak terdeteksi, meskipun komponen virus dapat dideteksi pada titer normal.Jenis gangguan siklus infeksi yang bergantung pada sel inang ini disebut infeksi abortif. Siklus infeksi awalnya diamati pada tikus yang terinfeksi ke otak dengan strain virus influenza non-neurotropik (Schlesinger, 1953). Semakin tinggi dosis virus yang diberikan, semakin besar jumlah hemaglutinin yang baru disintesis. Beberapa sel inang lainnya- sistem virus influenza A telah dijelaskan di mana hanya RNP-^ yang menghasilkan antigen dan hemagglutinin, tetapi bukan virus menular.Dalam semua sistem THT yang dipelajari sejauh ini, antigen RNP terakumulasi dalam nukleus dan tidak terdeteksi
dipersenjatai dengan bantuan antibodi fluoresen di sitoplasma (Henle et al., 1955; Franklin, Breitenfeld, 1959; Ter Meulen, Love, 1967; Fraser, 1967).
B.FENOMENA VON MAGNUS
Selama perjalanan serial virus influenza dengan multiplisitas yang lebih tinggi dari 1 (Barry, 1961), semakin banyak virus yang tidak lengkap terbentuk, yang muncul dari sel inang (von Magnus, 1951, 1952). Partikel-partikel virus ini memiliki struktur permukaan yang sangat mirip dengan virus influenza. struktur virus menular, bersifat imunogenik: dan menyebabkan gangguan homolog. Mengandung lebih sedikit RNA dan antigen RNP, menunjukkan rasio infektivitas terhadap aktivitas hemaglutinasi yang lebih rendah dan mengandung lebih banyak lipid daripada partikel virus lengkap (von Magnus, 1954; Isaacs, 1959; Pauker dkk., 1959; Rott dan Schafer, 1961; Rott dan Scholtissek, 1963).
Ketika menganalisis RNA dari sebagian virus, ditemukan bahwa RNA virus dengan berat molekul yang relatif tinggi tidak ada atau terdapat dalam jumlah yang berkurang, sedangkan jumlah RNA dengan berat molekul rendah meningkat (Duesberg, 1968; Pons, Hirst, 1969;Nayak, 1969).
Dalam sel yang terinfeksi virus influenza kedua yang tidak diencerkan, semua informasi genetik virus terdapat, karena cfRNA yang diisolasi dari sel-sel ini mampu mengubah, setelah hibridisasi, RNA berlabel yang diisolasi dari virus menular menjadi bentuk RNA yang sepenuhnya tahan azo. (Scholtissek, Rott, 1969b). Jadi, peningkatan jumlah RNA dengan berat molekul rendah dalam partikel tidak lengkap mungkin disebabkan oleh RNA dengan berat molekul tinggi, yang dapat dimasukkan ke dalam partikel-partikel ini dalam bentuk molekul yang hancur dan, oleh karena itu, tidak berfungsi. Gagasan ini didukung oleh data bahwa dengan saluran haus yang tidak diencerkan, kemampuan untuk menghasilkan virus menular pertama-tama menurun, setelah itu sintesis hemagglutinin, neuraminidase dan, akhirnya, antigen RNP menurun (Scholtissek et al., 1966).
Nayak (1972) menemukan bahwa selama perjalanan multiplisitas tinggi pertama, virus yang muncul lebih awal sepenuhnya menular dan menghasilkan pola normal dari fragmen RNA virus menular dalam gradien sukrosa, sedangkan virus yang muncul kemudian memiliki profil RNA yang khas tidak lengkap ( latar belakang) -Magnus) virus1.
- Dihidrotestosteron pada pria - fungsi, norma dan patologi
- Mendapatkan insulin: semua cara utama
- Bagaimana steroid mempengaruhi kelenjar prostat Bagaimana melindungi prostat selama kursus
- Bukan virus, bukan protein, tapi namanya prion, disingkat Prion
- Nutrisi yang tepat untuk sakit maag
- Pijat punggung terapeutik untuk skoliosis Pijat punggung yang berbeda 10 15
- Cara menghilangkan dahak pada bronkus di rumah
- Tanaman leher kanker. Pendaki gunung ular. Akar leher kanker
- Apa manfaat kombucha?
- Apa itu penyakit gembur-gembur: jenis dan pengobatan
- Biji rami untuk pengobatan ginjal
- Bagaimana cara kerja virus influenza?
- Kelebihan protein: seberapa berbahayanya?
- Standar testosteron selama pengendalian doping
- Cara menggunakan atropin dengan benar untuk pengobatan kompleks Tindakan pertanian atropin
- Apa itu hipogonadisme pada pria dan bagaimana cara mengobati penyakit ini
- Sendi pergelangan tangan adalah alat motorik sempurna pada ekstremitas atas
- Phosphatidylcholine - suntikan pembakar lemak
- Kapan dihidrotestosteron meningkat pada wanita dan pria?
- Diet untuk tirotoksikosis kelenjar tiroid Makanan apa yang tidak diperbolehkan untuk tirotoksikosis