Replikation av influensavirus sker i. Hur fungerar influensaviruset? Identifiering av influensavirus med hjälp av RTG
De är intracellulära obligatparasiter, vilket betyder att de inte kan replikera eller föra vidare sina gener utan hjälp. En enda viral partikel (virion) är själv inert. När ett virus infekterar en cell använder det enzymer och huvuddelen av cellens struktur för att replikera.
Till skillnad från vad vi ser i celldelningsprocesser som och, producerar virusreplikation många avkommor som förstör värdcellen och sedan infekterar andra celler i kroppen.
Viralt genetiskt material
Virus kan innehålla enkelsträngat/dubbelsträngat DNA eller RNA. Vilken typ av genetiskt material som finns i ett visst virus beror på dess natur och funktion. Den exakta karaktären av vad som händer efter att en värd har infekterats varierar beroende på virusets natur.
Replikationsprocessen kommer att vara annorlunda för dsDNA, ssDNA, dsRNA och enkelsträngade RNA-virus. Till exempel måste dubbelsträngade DNA-virus vanligtvis komma in i värdceller innan de kan replikera. Enkelsträngade RNA-virus replikerar emellertid primärt till värdceller.
När väl ett virus infekterar en värd produceras komponenter av den virala avkomman av cellulärt maskineri, och sammansättningen av den virala kapsiden är en icke-enzymatisk process. Virus kan vanligtvis bara infektera ett begränsat antal värdar. "Lås och nyckel"-mekanismen är den vanligaste förklaringen till detta fenomen. Vissa proteiner på viruspartikeln måste matcha vissa receptorproteiner på cellytan hos en viss värd.
Hur infekterar virus celler?
Den grundläggande processen för infektion och replikering av viruset sker i 6 steg:
- Adsorption - viruset binder till värdcellen.
- Inträde - viruset introducerar sitt genom i värdcellen.
- Virusgenomreplikation - Det virala genomet replikeras med hjälp av värdens cellstruktur.
- Montering - virala komponenter och enzymer bildas och börjar samlas.
- Mognad - virus utvecklas från de sammansatta komponenterna.
- Exit - nya virus bryter ut ur värdcellen på jakt efter nya offer att infektera.
Virus kan infektera alla typer av celler, inklusive
Familjen ortomyxovirus (grekiska orthos - korrekt, tukha - slem) inkluderar influensavirus typ A, B, C, som, liksom paramyxovirus, har en affinitet för mucin. Influensa A-virus infekterar människor och vissa djurarter (hästar, grisar, etc.) och fåglar. Influensavirus typ B och C är endast patogena för människor. Det första humana influensaviruset isolerades från människor 1933 av W. Smith, C. Andrews och P. Ladow (WS-stam) genom att infektera vita illrar. Senare klassificerades detta virus som typ A. 1940 upptäckte T. Francis och T. Megill influensavirus typ B och 1949 upptäckte R. Taylor influensavirus typ C. Vid klassificering av influensavirus har vissa svårigheter alltid har påträffats, associerade med deras antigena variation. Influensavirus delas in i tre typer A, B och C. Typ A inkluderar flera subtyper som skiljer sig från varandra i sina antigener - hemagglutinin och neuraminidas. Enligt WHO-klassificeringen (1980) är humana och animaliska influensavirus typ A indelade i 13 antigena subtyper baserade på hemagglutinin (H1-H13) och 10 baserade på neuraminidas (N1-N10). Av dessa inkluderar humana influensavirus typ A tre hemagglutininer (HI, H2 och NZ) och två neuraminidaser (N1 och N2) För virus typ A anges undertypen hemagglutinin och neuraminidas inom parentes. Till exempel influensa A-virus: Khabarovsk/90/77 (H1N1).Struktur och kemisk sammansättning
Influensaviruset har en sfärisk form, med en diameter på 80-120 nm. Trådliknande former är mindre vanliga. Nukleokapsiden av spiralsymmetri är en ribonukleoprotein (RNP)-sträng arrangerad i en dubbelspiral som bildar kärnan av virion. RNA-polymeras och endonukleaser (P1 och P3) är associerade med det. Kärnan är omgiven av ett membran bestående av M-proteinet, som förbinder RNP med ett lipiddubbelskikt av det yttre skalet och styloidprocesser bestående av hemagglutinin och neuraminidas.Virioner innehåller ca 1% RNA, 70% protein, 24% lipider och 5 % kolhydrater. Lipider och kolhydrater är en del av lipoproteinerna och glykoproteinerna i det yttre skalet och är av cellulärt ursprung. Virusets genom representeras av en minussträngsfragmenterad RNA-molekyl. Influensavirus typ A och B har 8 RNA-fragment, av dessa kodar 5 för ett protein och de sista 3 kodar för två proteiner vardera.Antigener
Influensavirus A, B och C skiljer sig från varandra i det typspecifika antigenet associerat med RNP (NP-protein) och M-matrisproteinet, vilket stabiliserar virionets struktur. Dessa antigener detekteras i RSC. Den snävare specificiteten hos virus av typ A bestäms av två andra ytantigener - hemagglutinin H och neuraminidas N, betecknade med serienummer Hemagglutinin är ett komplext glykoprotein med skyddande egenskaper. Det inducerar i kroppen bildandet av virusneutraliserande antikroppar - antihemagglutininer, detekterade i RTGA. Variabiliteten av hemagglutinin (H-antigen) bestämmer den antigena driften och förskjutningen av influensaviruset. Antigendrift hänvisar till mindre förändringar i H-antigenet orsakade av punktmutationer i genen som styr dess bildning. Sådana förändringar kan ackumuleras i avkomma under påverkan av selektiva faktorer som antikroppar. Detta leder i slutändan till en kvantitativ förändring, uttryckt i en förändring av hemagglutinins antigena egenskaper. Med antigenskifte sker en fullständig ersättning av genen, som kan vara baserad på rekombination mellan två virus. Detta leder till en förändring i subtypen av hemagglutinin eller neuraminidas, och ibland båda antigener, och uppkomsten av fundamentalt nya antigena varianter av viruset, vilket orsakar stora epidemier och pandemier.Hemagglutinin är också en receptor genom vilken viruset adsorberas på känsliga celler , inklusive erytrocyter, vilket får dem att klibba ihop och är involverad i hemolysen av röda blodkroppar Viralt neuraminidas är ett enzym som katalyserar klyvningen av sialinsyra från substratet. Det har antigena egenskaper och deltar samtidigt i frisättningen av virioner från värdcellen. Neuraminidas, liksom hemagglutinin, förändras som ett resultat av antigendrift och förskjutning.Odling och reproduktion
Influensavirus odlas i kycklingembryon och i cellkulturer. Den optimala miljön är kycklingembryon, i fostervattenhålan och allantoishålan i vilka viruset reproducerar sig inom 36-48 h. De känsligaste för influensaviruset är primärkulturer av mänskliga embryonala njurceller och vissa djur. Reproduktion av viruset i dessa kulturer åtföljs av en mild CPE, som påminner om spontan celldegeneration. Influensavirus adsorberas på glykoproteinreceptorer i epitelceller, in i vilka de penetrerar genom receptorendocytos. Transkription och replikering av det virala genomet sker i cellkärnan. I detta fall översätts de avlästa individuella RNA-fragmenten i form av m-RNA till ribosomer, där syntesen av virusspecifika proteiner sker. Efter replikering av det virala genomet bildas en pool av virala RNA, som används vid sammansättningen av nya nukleokapsider.Patogenes
Primär reproduktion av viruset sker i epitelcellerna i luftvägarna. Genom den eroderade ytan av slemhinnan kommer viruset in i blodet och orsakar viremi. Cirkulationen av viruset i blodet åtföljs av skador på endotelcellerna i blodkapillärerna, vilket resulterar i en ökning av deras permeabilitet. I svåra fall observeras blödningar i lungorna, hjärtmuskeln och andra inre organ. Influensavirus, som kommer in i lymfkörtlarna, skadar lymfocyter, vilket resulterar i förvärvad immunbrist, vilket bidrar till uppkomsten av sekundära bakterieinfektioner.Med influensa uppstår förgiftning av kroppen av varierande svårighetsgrad.Immunitet
Mekanismen för anti-influensa-immunitet är associerad med naturliga faktorer för antiviralt ospecifikt skydd, huvudsakligen med produktionen av interferon och naturliga mördarceller. Specifik immunitet tillhandahålls av faktorer för cellulärt och humoralt svar. De första representeras av makrofager och T-dödare. Den andra är immunglobuliner, främst antihemagglutininer och antineurominasantikroppar, som har virusneutraliserande egenskaper. Det senare, till skillnad från antihemagglutininer, neutraliserar endast delvis influensaviruset och förhindrar dess spridning. Komplementfixerande antikroppar mot det virala nukleoproteinet har inte skyddande egenskaper ens efter 1,5 månader. försvinner från konvalescenternas blod Antikroppar detekteras i blodserumet 3-4 dagar efter sjukdomsdebut och når maximala titrar efter 2-3 veckor. Varaktigheten av specifik immunitet som förvärvats efter influensainfektion, i motsats till tidigare uppfattningar, mäts i flera decennier. Denna slutsats kom baserad på en studie av åldersstrukturen för förekomsten av influensa orsakad av A (H1N1)-viruset 1977. Det visade sig att detta virus, som hade varit frånvarande sedan 1957, endast drabbade personer under 20 år år 1977. Efter att ha drabbats av en influensainfektion orsakad av influensavirus typ A bildas alltså en intensiv immunitet, strikt specifik för den subtyp av viruset (av H- och N-antigener) som orsakade dess bildande.Dessutom har nyfödda barn passiv immunitet på grund av IgG-antikroppar mot motsvarande virussubtyp A. Immuniteten varar i 6-8 månader.Epidemiologi
Smittkällan är sjuka människor och virusbärare. Överföring av patogenen sker genom luftburna droppar. Influensa är en epidemisk infektion som förekommer oftare under vintern och vinter-vårmånaderna. Ungefär vart tionde år blir influensaepidemier till pandemier som påverkar befolkningen på olika kontinenter. Detta förklaras av förändringen i H- och N-antigenerna av typ A-viruset associerat med antigendrift och skiftning. Till exempel orsakade influensa A-viruset med hemagglutinin NSW1 spanska sjukan pandemin 1918, som krävde 20 miljoner människoliv. 1957 orsakade det "asiatiska" influensaviruset (H2N2) en pandemi som drabbade mer än 2 miljarder människor. 1968 uppstod en ny pandemivariant, influensa A (H3N2)-viruset, kallat Hongkong-viruset, som fortsätter att cirkulera till våra dagar. 1977 fick det sällskap av viruset av typ A (H1N1), vilket var oväntat, eftersom ett identiskt virus redan hade cirkulerat 1947-1957 och då helt ersatts av den "asiatiska" subtypen. I detta avseende uppstod en hypotes om att skiftvarianter av viruset inte är historiskt nya. De representerar serosubtyper som cirkulerat under de senaste åren. Upphörandet av cirkulationen av influensaviruset, som orsakade nästa epidemi, förklaras av den kollektiva immuniteten hos befolkningen som har utvecklats till denna antigena variant av patogenen. Mot denna bakgrund finns ett urval av nya antigena varianter, som det ännu inte har bildats kollektiv immunitet mot.Det är ännu inte klart var de skiftande antigena varianterna (serosubtyper) av influensa A-viruset som kom ur aktiv cirkulation i en eller en annan historisk period är bevarad under lång tid. Det är möjligt att reservoaren för beständigheten av sådana virus är vilda och tama djur, särskilt fåglar, som är infekterade med mänskliga varianter av typ A-influensavirus och upprätthåller sin cirkulation under lång tid. Samtidigt sker genetiska rekombinationer mellan fågel- och mänskliga virus i fåglarnas kropp, vilket leder till bildandet av nya antigena varianter. Enligt en annan hypotes cirkulerar influensavirus av alla kända subtyper ständigt bland befolkningen, men blir epidemiskt relevanta endast med en minskning av den kollektiva immuniteten. Influensavirus av typ B och C kännetecknas av högre antigen stabilitet. Influensa B-virus orsakar mindre intensiva epidemier och lokala utbrott. Influensavirus typ C är orsaken till sporadiska sjukdomar.Influensaviruset förstörs snabbt av temperaturer över 56°C, UV-strålning, desinfektionsmedel och rengöringsmedel. Det förblir livskraftigt i 1 dag. vid rumstemperatur, på släta metall- och plastytor - upp till 2 dagar. Influensavirus överlever vid låga temperaturer (-70°C).Specifik förebyggande
För att förebygga influensa används rimantadin, som undertrycker reproduktionen av influensavirus typ A. För passiv prevention används humant anti-influensa-immunoglobulin, erhållet från blodserumet från donatorer immuniserade med influensavaccin. Humant leukocytinterferon har en viss effekt Levande och inaktiverade vacciner används för att förebygga vaccin. När levande vacciner administreras bildas både allmän och lokal immunitet. Dessutom noteras interferoninduktion För närvarande har inaktiverade vacciner av olika typer erhållits: virion, subenhet, split och mixed. Virion-vacciner produceras genom högkvalitativ rening av virus som odlas i kycklingembryon. Subenhetsvacciner är renade ytantigener från influensaviruset - hemagglutininer och neuraminidas. Sådana vaccinberedningar kännetecknas av reducerad reaktogenicitet och hög immunogenicitet. Klyvda eller sönderdelade vacciner framställs från en renad virionsuspension genom behandling med detergenter. Det finns dock fortfarande ingen konsensus om överlägsenheten hos något av dessa vacciner. Inaktiverade vacciner inducerar ett immunsvar i systemet med allmän och lokal humoral immunitet, men inducerar interferonsyntes i mindre utsträckning jämfört med levande vacciner.Mångårig erfarenhet av användning av levande och inaktiverade vacciner indikerar att den antigeniska obalansen av vaccinstammar med epidemiska sådana är den främsta, men inte den enda orsaken till låg effektivitet av förebyggande av influensavaccin. På senare år har försök gjorts att skapa genetiskt modifierade och syntetiska influensavacciner.Influensa
Influensa är en akut andningssjukdom hos människor som tenderar att spridas epidemiskt. Det kännetecknas av katarral inflammation i de övre luftvägarna, feber och allvarlig allmän berusning. Influensa åtföljs ofta av allvarliga komplikationer - sekundär bakteriell lunginflammation, exacerbation av kroniska lungsjukdomar Influensapatogener tillhör familjen Orthomyxoviridae. Den innehåller tre typer av virus - A, B, C. Influensaviruset har en sfärisk form, dess storlek är 80-120 nm. Ibland bildas filamentösa virioner. Genomet bildas av ett enkelsträngat minussträngat RNA, som består av åtta fragment, och omges av en proteinkapsid. RNA associerat med 4 interna proteiner: nukleoproteiner (NP) och högmolekylära proteiner PI, P2, R3, involverade i genomtranskription och virusreplikation. Nukleokapsiden har en spiralformad typ av symmetri. Ovanför kapsidskalet finns ett lager av matrisprotein (M-protein). På det yttre superkapsidskalet finns hemagglutinin (H) och neuraminidas (N) i form av ryggar. Båda glykoproteinerna (N och H) har uttalade antigena egenskaper. I influensavirus hittades 13 olika antigena typer av hemagglutinin (NI-13) och 10 varianter av neuraminidas (N1-10) Baserat på det interna nukleoproteinantigenet urskiljs tre typer av influensavirus - A, B, C, som kan bestämmas i RSC. Typ A-virus som infekterar människor har tre typer av hemagglutinin (HI, H2, H3) och två neuraminidaser (N1, N2). Beroende på deras kombinationer särskiljs varianter av influensa A-virus - H1N1, H2N2, H3N2. de bestäms i hemaggmed lämpliga sera Influensavirus odlas lätt i kycklingembryon och olika cellkulturer. Maximal ansamling av virus sker efter 2-3 dagar. I den yttre miljön förlorar viruset snabbt sin smittsamhet genom uttorkning. Vid låga temperaturer i kylskåpet lagras det i en vecka, vid -70 ° C - mycket längre. Uppvärmning gör att den inaktiveras efter några minuter. Under påverkan av eter, fenol, formaldehyd, förstörs det snabbt.Virologisk diagnostisk metod
Materialet för forskning är svabbar från nasofarynx, nasala flytningar, som tas med torra eller våta sterila bomullspinnar under de första dagarna av sjukdomen, sputum. Virus kan hittas i blod och cerebrospinalvätska. I fall av dödliga fall avlägsnas bitar av de drabbade vävnaderna i övre och nedre luftvägarna, hjärnan etc. Nasofaryngeala pinnar tas på fastande mage. Patienten ska gurgla tre gånger med steril saltlösning av natriumklorid (10-15 ml), som samlas upp i en steril vidhalsad burk. Torka efter detta av svalgets bakvägg och näsgångarna med en bit steril bomullsull, doppa den sedan i en burk med sköljning. Du kan ta materialet med en steril pinne fuktad i en natriumkloridlösning, som används för att torka noggrant av bakväggen i svalget. Efter att ha samlat in materialet nedsänks pinnen i ett provrör med fysiologisk lösning, till vilken 5% inaktiverat djurserum tillsätts. I laboratoriet sköljs svabbarna i vätska, pressas mot sidan av röret och tas bort. Avloppet förvaras i kylen för att sedimentera, sedan samlas den mellersta delen av vätskan upp i sterila rör. Antibiotika penicillin (200-1000 IE/ml), streptomycin (200-500 μg/ml), nystatin (100-1000 IE/ml) tillsätts till materialet för att förstöra medföljande mikroflora, förvaras i 30 minuter i rumstemperatur och används för att isolera virus. har tidigare kontrollerat det för sterilitet. En känslig metod för att isolera virus som infekterar 10-11 dagar gamla kycklingembryon. Material i en volym av 0,1-0,2 ml injiceras i fostervattens- eller allantoishålan. Som regel är 3-5 embryon infekterade. Embryon inkuberas vid en optimal temperatur på 33-34 ° C i 72 timmar. För att öka antalet virioner i testmaterialet förkoncentreras det. För att göra detta använder de metoder för adsorption av virus på röda blodkroppar från kyckling, behandling med en 0,2% trypsinlösning för att förbättra virusens infektionsegenskaper eller fäller ut dem med speciella metoder. Efter inkubation kyls kycklingembryon vid en temperatur på 4 ° C i 2-4 timmar, sedan sugs av med steril med pipetter eller en spruta, allantois eller fostervatten. I detta fall bestäms närvaron av ett infektiöst virus med hjälp av RGA. För att göra detta, blanda lika volymer (0,2 ml) virusresistent material och 1 % suspension av röda blodkroppar från kyckling. En positiv reaktion (närvaro av ett virus i materialet) indikeras av sedimentering av erytrocyter i form av ett paraply. Om det finns ett virus i materialet som har hemagglutinösa egenskaper, titreras det med hjälp av en expanderad RGA, vilket bestämmer titer av hemagglutinös aktivitet. Med hjälp av denna reaktion bestäms titern för det hemagglutinerande viruset - den högsta utspädningen av materialet som fortfarande ger hemagglutinationsreaktionen. Denna mängd virus tas som en hemagglutinös enhet (HAU).Identifiering av influensavirus med RTGA
För att göra detta, förbered först en fungerande utspädning av det virala materialet, som innehåller 4 GAO av viruset i en viss volym. Reaktionen beaktas efter bildandet av ett sediment av erytrocyter i kontrollbrunnarna. En positiv reaktion indikeras av en fördröjning av hemagglutination i testbrunnarna Influensavirus kan isoleras med hjälp av olika cellodlingslinjer - mänskligt embryo, apnjurar, kontinuerlig hundnjurcellinje (MDCK) och andra. I cellkulturer manifesteras den cytopatiska effekten av virus (uppkomsten av celler med bågade kanter, vakuoler, bildandet av intranukleära och cytoplasmatiska inneslutningar), vilket slutar med degenereringen av cellmonoskiktet. För att identifiera de isolerade virusen används RTGA (förutsatt att hemagglutinintitern i odlingsvätskan är minst 1:8). Utöver denna reaktion kan man använda RGGads, dock är det mindre känsligt och kräver en immunserumtiter på minst 1:160 samt RSK, RN, REMA osv.Serologisk studie
Serologiska tester används för att bekräfta diagnosen influensa. Den bygger på att bestämma en fyrfaldig ökning av antikroppstitern i patientens serum.Det första serumet erhålls vid sjukdomsdebut i den akuta perioden (2-5-1 dagars sjukdom), det andra - efter 10- 14:e dagen av sjukdomen. Eftersom serumen kan blandas samtidigt, förvaras den första av dem i kylskåpet vid en temperatur på -20 ° C. Oftast används RTGA, RSK, RNGA. Dessa reaktioner utförs med speciella uppsättningar av standardvirusdiagnostik (referensstammar av influensavirus av olika serologiska typer). Eftersom patientserum kan innehålla ospecifika hemagglutinationshämmare, värms de först till en temperatur på 56 ° C och behandlas även med ett speciellt enzym (till exempel neuraminidas) eller lösningar av kaliumperjodat, rivanol, manganklorid, vit däckupphängning, etc. enligt särskilda system. OCHHemagglutinationsinhiberingsreaktion
Hemagglutinationshämningsreaktionen kan utföras i provrör (macromsh tod) eller i speciella plattor för immunologiska studier.Reaktionen anses vara positiv när ett kompakt, tätt sediment av röda blodkroppar med släta kanter bildas.Expressdiagnostik
Metoden bygger på att identifiera specifika virala antigener i testmaterialet med hjälp av immunfluorescens i direkt eller indirekt RIF. Slem erhålls från näsgångarna eller bakväggen i svalget, centrifugeras och utstryk bereds på objektglas från sedimentet av kolumnära epitelceller i slemhinnan. de behandlas med immunofluorescerande sera konjugerade till fluorokromer, till exempel FITC (fluoresceinisotiocyanat). När man undersöker läkemedel med hjälp av ett fluorescerande mikroskop observeras ett karakteristiskt gröngult sken av influensavirus, som är lokaliserade i början av sjukdomen i epitelcellers kärnor. Nyligen har det föreslagits att använda ELISA, RZNGA och PCR för att indikera specifika virala antigener.Adsorption
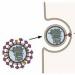
Den berömda "H5N1" står för "hemagglutinin typ fem, neuraminidas typ ett" - dessa två proteiner sticker ut på ytan av influensaviruset (i fig. 1 är hemagglutinin grönt och neuraminidas är grått).
Med hjälp av hemagglutinin fäster influensaviruset till receptorer på cellytan. Det ursprungliga målet för viruset är cellerna i det cilierade epitelet i luftvägarna, men det är inte därför vi älskar det: hemagglutinin kan fästa vid receptorerna i många andra celler, inklusive röda blodkroppar. Om ett virus fäster vid två (intilliggande) röda blodkroppar samtidigt, kommer de röda blodkropparna att hålla ihop! Därav namnet på proteinet - "blodlimning".
ris. 1
Genomförande
Den dumma cellen absorberar viruset som har fäst sig vid den genom fagocytos - liksom, äter det. Varför, varför stoppar barn alltid alla möjliga elaka saker i munnen?! Viruset finns dock fortfarande inne i cellen som föda, inuti en fagocytotisk vesikel (i Fig. 2 - "endosom"). Endosomen smälter samman med lysosomen, en matsmältningsvakuol bildas, protoner pumpas in i den från cytoplasman för att skapa en sur miljö (denna process visas i fig. 2) - lite mer, och vi kommer att smälta viruset (med ord "proteinmat, vad är skillnaden").

ris. 2
Remsa
Men viruset är redo för denna händelseutveckling:
 ris. 3 |
- Hemagglutinin modifieras under påverkan av en sur miljö - dess yta blir hydrofil, och den (tidigare fäst vid receptorn på den inre ytan av endosommembranet, nu) är inbäddad i detta membran.
- Protoner som pumpas in i endosomen passerar genom speciella kanalproteiner (M2-proteiner, indikerade i Fig. 1 och Fig. 3) genom virusets lipidskal och når virusets proteinskal (i Fig. 1 - en cirkel av vita bollar) - M1-proteiner). På grund av detta förstörs proteinskalet (i fig. 3 indikeras M1-proteinerna i det förstörda proteinskalet som röda stjärnor).
- Virusets lipidhölje (på grund av hemagglutinins penetrerande verkan) smälter samman med (lipid)membranet i fagosomen; Virusets RNA hamnar i cellens cytoplasma.
Virusreplikation
Det virus-RNA som släpps ut i cytoplasman är i sig själv helt säkert.
- Proteiner kan inte göras på det, eftersom det är minus RNA (proteiner kodas inte av det, utan av den komplementära plussträngen, som ännu inte existerar).
- Det är också omöjligt att göra RNA på det - våra celler har i allmänhet inte ett enzym som kan fördubbla RNA.
"Oh-ho-ho, du har ingenting," muttrar influensaviruset och skakar på sitt mustaschförsedda huvud, "men det är okej, jag tog med mig allt." Viruset förde med sig proteinerna PB1, PB2 och PA, som tillsammans bildar det virala RNA-beroende RNA-polymeraset – det kan duplicera RNA. Men otur! Alla polymeraser behöver en primer för att börja fungera, men den glömska influensan tog det inte med sig! Allting är över?!
Lugna dig, få inte panik! – Med dessa ord skickas hela företaget (8 virala RNA och 3 virala enzymer) till cellkärnan. Där får influensan full service:
- primrar för viral RNA-replikation (för att erhålla plus-RNA) är sektioner som spjälkas från cellulärt RNA;
- bearbetning: sektioner som fungerade som primrar för RNA-syntes - dessa var kapslar, så modifieringen av 5"-änden utfördes i början; i slutet av syntesen inträffar polyadelation av 3"-änden;
- splitsning: visst viralt RNA som innehåller information för två proteiner skärs i två delar.
På detta sätt syntetiseras plus-RNA, som kan fungera som mallar för syntes av virala proteiner och virala minus-RNA.
Sedan är allt enkelt: den dumma cellen, med sina egna ribosomer från sina egna aminosyror, syntetiserar virusets proteiner, inklusive RNA-beroende RNA-polymeras. Influensa minus RNA produceras också kraftigt inuti kärnan. Sammansättningen av virala partiklar sker i cytoplasman, på den inre ytan av cellmembranet. Det färdiga viruset lämnar cellen genom exocytos (knoppande), neuraminidas biter den sista tråden som förbinder cellen och det nyfödda viruset... Ett nytt (ondskefullt) litet liv kommer ut i världen!

ris. 4
K. SOLTISSEK och H.-D. KLENK (SN. SCHOLTISSEK, H.-D. KLENK)
I. INLEDNING
Det finns ett antal recensioner om problemet med replikering av influensavirus. Litteraturen före 1968 sammanfattas i artiklar av Hoyle (1968) och Scholtissek (1969); nyare verk inkluderar recensioner av White (1973) och Compans och Choppin (1974).
De flesta data om replikation erhölls från studien av influensavirus typ A. Signifikanta skillnader i replikationsmekanismerna för andra typer av influensavirus har ännu inte hittats.
Flera cellodlingssystem har blivit utbredda som är lämpliga för att studera replikation, till exempel förökning av WSN-stammen av influensavirus i MDBK-celler (Choppin, 1969) eller förökning av hönspestvirus (FPV) i fibroblastceller från kycklingembryon. Ett exempel på tillväxtkurvan för det sista viruset i en enstaka cykel har bevisats i 30, där den latenta perioden är cirka 3 timmar och virusproduktionen når en platå mellan 8 och 12 h. I allmänhet har sådana cellsystem en hög avkastning av infektiöst virus observeras, och syntesen av cellulära proteiner undertrycks mycket effektivt efter infektioner. Därför är sådana system mycket lämpliga för biokemisk forskning.
II. ADSORPTION, PENETRATION, "STRIPPNING" AV VIRUSET
Infektion av en cell med ett virus börjar med adsorption, d.v.s. vidhäftning av den virala partikeln till cellytan. För vidhäftning krävs två komplementära strukturer, nämligen: receptorställen på cellytan och den virala komponent som ansvarar för att känna igen dessa receptorställen Influensavirusets förmåga att interagera med erytrocyter av olika ursprung och agglutinera dem har varit känd i många år (Hirst, 1941; McClelland, Hare, 1941) Hemagglutination har använts som en modellreaktion för interaktionen av influensavirus med cellytan, och "det mesta av din kunskap om detta fenomen kommer från liknande studier. Man bör dock vara mycket försiktig med generaliseringar, eftersom strukturerna på ytan av erytrocyter och ytan på infekterade celler kan vara helt olika (se även kapitel 3).
A. HEMAGGLUTIININ ROLL I ADSORPTION
Komponenten i virionet som är involverad i bindningen är HA* "spiken". Virala β-proteiners roll i initieringen av infektion studerades med användning av antikroppar specifika mot två ytproteiner: HA* och NA*. Dessa antikroppar kan erhållas med användning av rekombinanta virus. Till exempel resulterar en korsning mellan AO- och A2-virusen i bildningen av den rekombinanta X7F1, som bär HA*, AO och NA* A2 (Kilbourne et al., 1968). Antiserum mot X7F1-viruset hämmar inte NA* av influensavirus av AO-typ, men hämmar hemagglutination och neutraliserar infektionsförmågan hos virus av denna typ. Interaktionen av samma serum med influensa A2-virus hämmar inte hemagglutination eller smittsamhet, även om neutraliseringen av NA*-aktiviteten är fullständig. Således är NA* inte involverad i processen att initiera infektion, och endast NA* verkar vara ansvarig för adsorption. Detta koncept stöds av data om att virala partiklar från vilka endast neuraminidas "spikar" togs bort av proteolytiska enzymer förblev infektiösa (Schulze, 1970).
Det finns bevis för att den hemagglutinerande delen är lokaliserad på den yttre delen av HA* "spiken", som är rik på kolhydrater (se kapitel 3). Kolhydrater verkar vara väsentliga för HA*-funktionen, eftersom icke-glykosylerade HA*-proteiner inte kan binda till röda blodkroppar (Klenk et al., 1972b).
B. RECEPTOR FÖR INFLUNVIRUS
Kolhydrater är en väsentlig komponent inte bara av hemagglutinin, utan också av den virala receptorn på cellytan. Hirst (1942) observerade att virus-erytrocytkomplexet är instabilt och att receptorn på cellens yta förstörs av virusenzymet Som senare visades är detta enzym neuraminidas, som klyver neuramsyra från glykoproteiner (Klenk et al., 1955; Klenk, Stoffel, 1956; Gottschalk, 1957) Detta var den första demonstrationen av ett enzym som är en integrerad del av en viral partikel Bakteriella neuraminidaser kan också förstöra influensavirusreceptorer (Burnet, Stone, 1947) Sålunda fann man att receptorn för influensaviruset är ett glykoprotein innehållande neuraminsyra.
Sedan dess har en stor mängd information samlats
om myxovirusreceptorn, sammanfattad nyligen i en recension
Hughes (1973). De erhållna uppgifterna är kortfattat sammanfattade enligt följande:
blåser Receptorområden innehåller rester av neuromi-
joonsyra, som finns i kolhydratkedjor
glykoproteiner. Icke-oxiderande terminala rester av neuromi-
nosnla är nödvändiga för interaktionen av glykoproteiner med virus
Rus influensa. Behandling med neuraminidas tar helt bort
bindande aktivitet. Nedbrytningsstudier med är
med perjodat antas det för anslutningen
aktivitet kräver en intakt neuraminmolekyl
syror (Suttajit och Winzler, 1971). karboxylgrupp,
spelar förmodligen också en viktig roll, eftersom det är nödvändigt
uppenbarligen och elektrostatiska krafter (Huang, 1974).
Det verkar troligt att det bara finns en svag krydda
fysiskhet i förhållande till den struktur som den är förknippad med
neuraminsyra, eftersom det har visats det hela
en uppsättning glykoproteiner som innehåller jaeuraminsyra,
binder till myxovirus. Dessutom, gangliosider (gly-
är aktiva i detta avseende (Haywood, 1975).
Förhoppningen är att frågan om bindning av influensavirus kommer att bli tydligare när receptorns molekylära struktur är etablerad. Till viss del har detta redan uppnåtts i fallet med erytrocyter (Marchesi et al., 1973). Ytterligare information kan också tillhandahållas genom att studera bindningen av myxovirus till artificiella membran (Tiffany och Blough, 1971).
B. MÖJLIGA MEKANISMER FÖR INTRÄNGNING OCH "STRIPNING"
Två olika "penetrations- och "avklädningsmekanismer" av inte bara influensaviruset utan även virus i allmänhet som har ett yttre skal har föreslagits. Båda synpunkterna baseras huvudsakligen på studier i elektronmikrotrenchen. En av dessa mekanismer är vironexis, som tros vara en process av ppnocytos, när viruspartiklar ingår i pinosomer, som sedan smälter samman med lysosomer, och lysosomenzymer orsakar "avklädning" av viruset (Fazekas de St. Grot, 1948). Elektronmikroskopisk bekräftelse av denna synvinkel erhölls i verk av Dales och Choppin (1962), och Dourmashkin och Tyrrell (1970). Vid 10 minuter efter infektion var viruspartiklar synliga i direkt kontakt med cellytan, och efter 20 minuter var partiklar synliga. I motsats till denna studie av Morgan och Rose (1968) antyder att inträde kan bero på fusion av det virala höljet med värdcellmembranet. Därför finns det för närvarande ingen konsensus om mekanismen för inträde av influensavirus.
Som beskrivs i kap. 5 innehåller influensavirusvirioner RNA-polymeras associerat med deras ribonukleoproteinkomponenter. Det är därför osannolikt att processen att "avkläda" skulle vara rumsligt separerad från processen för frisättning av ribonukleoprotein. Och detta stadium inträffar på cellytan, enligt mekanismen för membranfusion, och i fagocytiska vesiklar, enligt virohexis-mekanismen.
III. TRANSKRIPTION A. RNA-SYNTESSEKVENS
Efter "avklädning" måste virionens sRNA transkriberas till komplementärt RNA. RNA-polymeraset som introduceras med den infekterande partikeln måste fungera i det första steget av virusutbredning (se kapitel 5). Influensavirusgenomet kan isoleras från virioner endast i form
separata fragment (se kapitel 6). Dessutom fungerar det i form av separata fragment, vilket framgår av genetisk analys (kapitel 7) och stegvis inaktivering av ett infektiöst virus (Scholtissek, Rott, 1964) I detta avseende bör det antas att polymeraset initierar syntesen RNA i varje enskilt fragment Eftersom RNA inte finns i cellen som en fri molekyl, utan alltid är klädd med ett protein, uppstår frågan: vilket protein förknippas det virala RNA:t med under sin replikation?
Experiment som genomförts för att studera syntesen av RNA från influensaviruset ger stora svårigheter, eftersom aktinomycin D inte kan användas för att detektera produktionen av viralt RNA när man specifikt undertrycker syntesen av cellulärt RNA, eftersom detta antibiotikum undertrycker reproduktionen av influensaviruset ( Barry et al., 1962; Rott, Scholtissek, 1964; Barry et al., 1965; Pons, 1967). Av denna anledning, för att bestämma tidssekvensen för RNA-syntes, användes specifik hybridisering av pulsmärkt RNA vid olika punkter efter infektion med ett överskott av antingen omärkt vRNA eller vcRNA, följt av behandling med RNas (Scholtissek och Rott, 1970). I de tidiga stadierna av den infektiösa cykeln rådde vcRNA-syntes och nådde ett maximum ungefär under den andra timmen efter infektion, medan i de senare stadierna var det mesta av det virusspecifika RNA som producerades vRNA. Krug (1972), med en annan metod, visade också att 4 timmar efter infektion upphör BIKRNA-syntesen nästan helt. Efter fenolextraktion detekteras en relativt liten mängd lncRNA (Scholtissek och Rott, 1970).
På grund av det faktum att en eller annan typ av viralt RNA har informations1!! fungerar och används som en mall för syntes av virala proteiner (se avsnitt IVA), kan det förekomma viss translationell kontroll på nivån av differentiell katabolism av viralt RNA. Därför utfördes puls-chase-experiment för att studera stabiliteten av influensavirus-RNA in vivo. Det har fastställts att, i motsats till cellulärt RNA, är båda typerna av viralt RNA helt stabila under 90-dagarsperioden (Scholtissek et al., 1972).
Tidigare, när man studerade syntesen av viralt RNA in vivo, när aktinomycin D tillsattes i de sena stadierna av infektionscykeln (Duesberg och Robinson, 1967; Nayak, 1970; Ma-hy, 1970), tog man inte hänsyn till att antibiotikumet hämmar specifikt syntesen av komplementärt RNA in vivo (Scholtissek och Rott, 1970; Pons, 1973). Eftersom lncRNA frisätts från infekterade celler i form av minst fem separata fragment, drogs slutsatsen att viralt RNA också syntetiseras i form av fragment (Pons och Hirst, 1968).
B. LOKALISERING AV VIRAL RNA-SYNTES INNE I VÄRDCELLEN
Från data erhållna genom autoradiografi drogs slutsatsen att platsen för viral RNA-syntes verkar vara cellkärnan (Scholtissek et al., 1962; Barry et al., 1974). Eftersom pulsperioderna som användes i dessa studier fortfarande var för långa kan det inte uteslutas att viralt RNA syntetiseras i cellens cytoplasma och sedan transporteras till kärnan, där det kan ackumuleras. Dessutom kan vRNA och cRNA syntetiseras på olika platser i cellen.
B. HÄMNING AV VIRAL RNA-SYNTES 1. Actimomycin D, mithramycin och a-amanitin
När aktinomycin D eller mithramycin, som stör DNA-mallfunktionen, läggs till infekterade celler vid en tidpunkt då viralt RNA-beroende RNA-polymeras redan är närvarande (till exempel 2 timmar efter infektion), fortsätter vRNA att syntetiseras i cirka 2 till VcRNA-produktionen upphör dock omedelbart. Senare minskar också vRNA-syntesen, vilket indikerar att den kräver kontinuerlig bildning av vRNA (Rott et al., 1965; Scholtissek och Rott, 1970; Scholtissek et al., 1970; Pons, 1973). Gregoriades (1970) visade att aktinomycin D också har en stark effekt på vRNA-syntesen när den tillsätts sent i infektionscykeln. I dessa experiment bestämdes syntesen av viralt RNA genom ökningen av inkorporeringen av märkt uridin i det totala RNA:t av infekterade celler. Denna ökning kan elimineras genom tillsats av aktinomycin D. Man bör dock komma ihåg att influensavirusinfektion orsakar en ökning av inkorporeringen av märkt uridin i cellen efter infektion (Scholtissek et al., 1967) och att aktinomycin D har en hämmande effekt på denna inkorporering (Scholtissek et al., 1967). ., 1969). siAmanitin, som inte har någon affinitet för DNA, påverkar aktiviteten hos ett av de cellulära RNA-polymeraserna (RNA-podimeras II), och hämmar även syntesen av cRNA när det tillsätts till odlingsvätskan omedelbart efter infektion (Rott och Scholtissek, 1970; Mahy et al. al., 1972).
Mekanismen för specifik hämning av cfRNA-syntes av dessa antibiotika är inte helt klar, eftersom de inte påverkar bildningen av cfRNA in vitro. Dessa antibiotika verkar alltså endast in vivo, även om enzymet som syntetiserar cfRNA kan isoleras från celler till vilka 2 timmar efter infektion tillsattes aktinomycin D (Scholtissek och Rott, 1969a).
Reproduktionen av influensavirus kan också undertryckas av andra effekter på värdcellens DNA - införandet av mitomcin C, förbehandling med ultraviolett bestrålning eller avlägsnande av cellkärnor före infektion (Barry, 1964; Rott et al., 1965; Nayak, Rasmussen, 1966; Fol-Lett et al., 1974; Kelly et al., 1974). Mekanismen genom vilken dessa effekter påverkar replikationen av influensaviruset kan vara densamma som verkningsmekanismen för andra antibiotika.Det enda antagande som kan göras från dessa studier är att det finns ett behov av "funktionellt" aktiva cellkärnor och (eller) i cellens DNA-beroende funktion för förökning av influensavirus. Det är omöjligt att säga vilka dessa funktioner är.
2. Cykloheximid
När cykloheximid, som specifikt hämmar proteinsyntesen i djurceller, tillsätts 2 timmar efter infektion med influensaviruset upphör bildningen av vRNA omedelbart, medan bildningen av vRNA fortfarande fortsätter i minst 2 timmar (Scholtissek och Rott, 1970; Pons 1973). Det är ännu inte känt om kontinuerlig syntes av det virala eller cellulära proteinet som används som en "Kvalitet/kofaktor för polymeraset som syntetiserar vRNA krävs, eller om något "protein (t.ex. NP-protein) krävs för att stabilisera det nyligen syntetiserade vRNA, eller undertryckande av syntesen av ett specifikt viralt "protein leder till kontinuerlig bildning av cRNA, vars syntes normalt stängs av 3 timmar efter infektion. Denna avstängning kan vara nödvändig för att trigga vRNA-syntes.Studier med temperaturkänsliga mutanter bör besvara några av dessa frågor.
Experiment av Bean och Simpson (1973) visade att primär transkription in vivo (syntes av cRNA på en RNA-mall med användning av polymeraset från den infekterande partikeln) inte undertrycks av cykloheximid, medan aktinomycin D undertrycker transkriptionen fullständigt. Således påverkar cykloheximid inte aktiviteten av polymeraset som introduceras med den infektiösa partikeln och syntetisera cfRNA in vivo, men det undertrycker syntesen av ett nytt polymeras som är nödvändigt för produktionen av cfRNA.
3. Glukosamin
Glukosamin är känt för att tömma UTP-poolen i kycklingembryoceller genom att bilda UTP-]M-acetylglukosamin (Scholtissek, 1971). När Earls lösning innehållande glukos används som odlingsmedium, är det
har endast effekt på syntesen av virala glnkoproteiner (se avsnitt V). Om emellertid glukos som energikälla ersätts med lyruvat eller fukos, sker utarmningen av UTP-poolen av dessa aminosocker ungefär 10 gånger mer aktivt. Under dessa förhållanden blir värdcellens UTP-pool en specifik begränsning av hastigheten för vRNA-syntes, medan syntesen av cellulärt RNA ännu inte påverkas (Scholtissek, 1975). Som ett resultat av undertryckandet av viral RNA-syntes, bildning av virala proteiner saknas också.
Dessa data kan tolkas på två sätt: antingen har det virala RNA-beroende RNA-polymeraset låg affinitet för UTP jämfört med cellulära DNA-beroende och RIC-polymeraser, eller så finns det två mer eller mindre oberoende pooler av UTP i cellen, en av som kan användas för viral RNA-syntes och påverkas mer av glukosamin än den andra poolen, som kan användas som substrat av RNA-polymeraser.
D. SYNTES AV VIRAL RNA IN VITRO
I celler infekterade med influensavirus upptäckte flera forskare RNA-beroende RNA-polymeras (Ho, Walters, 1966; Scholtissek, Rott, 1969a; Skehel, Burke, 1969; Ruck et al., 1969; Mahy, Bromley, 1970; Compans, Caliguiri 1973). Det mesta av enzymaktiviteten hittades i den mikrosomala fraktionen av infekterade celler. I in vitro-systemet avlägsnas denna aktivitet av RNas, men inte av DNAs. Detta betyder att den interna mallen är RNA- Reaktionen kräver närvaro av alla fyra nukleosidtrifosfater och är känslig för aktin-icin D. Det mesta av produktionen av in vitro-reaktionen har en låg relativ molekylvikt. Data från Horisberger och Guskey (1973) tyder på att två olika enzymaktiviteter finns i cytoplasman: den ena är Mg++-beroende och hämmas av relativt höga saltkoncentrationer, den andra är Mn++-beroende och mer saltresistent. Den senare enzymaktiviteten finns också inuti viruspartikeln (se kapitel 5).
Motstridiga resultat har erhållits beträffande den cytoplasmatiska enzymprodukten i in vitro-systemet. Ruck ■ et al. (1969) rapporterade att detta enzym i deras händer syntetiserar åtminstone "några av viriontyp RNA (14 till 19S). Författarna kom till denna slutsats när de bestämmer bassammansättningen av produkten i ett in vitro-system efter inkubation av den mikrosomala fraktionen med alla fyra märkta nukleosidtrifosfater med känd specifik radioaktivitet. Data från studien av närmaste
till grannar med adenylsyra, erhållna i samma arbete med [(a-32P]ATP, överensstämmer med analysdata från närmaste granne som erhållits av Scholtissek (1969), vilket resulterade i slutsatsen att produkten i in vitro-systemet har strukturen Mahy och Bromley (1970) i sin ursprungliga publikation angav också att någon del av produkten i ett in vitro-system som produceras av ett cytoplasmatiskt enzym måste "vara vRNA." Men nyligen Hastie och Mahy (1973) i närmaste grannanalys och specifik hybridisering bekräftade bildandet av det cytoplasmatiska enzymet nästan uteslutande av cRNA, vilket först visades av Scholtissek (1969). Caliguiri och Compans (1973) isolerade också RNA-polymeras från cytoplasman hos celler infekterade med influensavirus, som syntetiserade RNA i en in vitro-system utan mindre än 90% av vilka har en bassekvens som är komplementär till hsRNA. Hastie och Mahy (1973) "fann att en betydande andel av produkten i in vitro-systemet som syntetiserats av kärnenzymet i närvaro av aktinomycin D var inte kan pibridisera med omärkt vRNA. Det är ännu inte klart vilken RNA-typ som inte är kapabel till sådan hybridisering. Mycket lite av det RNA som syntetiseras under dessa betingelser hybridiserar med omärkt aRNA (Scholtissek, opublicerade data).
Kinetiken för inkorporering av märkt GTP i viralt RNA kan tolkas som att det inte finns någon återinitiering av RNA-syntes i in vitro-systemet. Om ett orent enzympreparat inkuberas vid låga saltkoncentrationer är nästan allt nysyntetiserat RNA initialt enkelsträngat. Efter extraktion med fenol blir emellertid "en stor andel av RNA RNAas-resistent. Fenol omvandlar den mellanliggande replikationsstrukturen, bestående av en enkelsträngad mall och nysyntetiserat cRNA, som hålls samman vid replikationsstället av en polymerasmolekyl, till en delvis dubbelsträngad struktur (Feix et al., 1967; Oberg, Philipson, 1971). Dessa data om influensavirusenzymprodukten i ett in vitro-system kan tolkas som att polymeraset inte bara initierar och fortsätter polymerisationen, utan det dissocierar den nysyntetiserade kedjan från dess mall. Annars bildas en dubbelsträngad RNA-struktur, som inte har några biologiska funktioner (Paffenholz och Scholtissek, 1973) Om inkubation utförs vid höga saltkoncentrationer eller med renat enzym är en stor andel av produkten redan dubbelsträngat RNA före fenolextraktion (Schwartz, Scholtissek, 1973).
Denna egenskap hos influensavirus-RNA-polymeras att syntetisera uteslutande cfRNA i ett in vitro-system har utnyttjats.
Det kallas att fastställa det genetiska förhållandet mellan olika stammar av influensavirus genom att bestämma homologin i bassekvensen mellan dem (Scholtissek, Rott, 1969b; Hobson, Scholtissek, 1970; Anschutz et al., 1972).
IV. SYNTES AV VIRALA PROTEINER
A. IN VITRO ÖVERSÄTTNING
Problemet med vilken typ av RNA - virjoniskt eller komplementärt - som är informativt för syntesen av virala proteiner har ännu inte lösts. Motstridiga resultat har erhållits angående typen av virusspecifikt RNA som är associerat med polysomer. Nayak (1970) upptäckte en sackarosgradient i den polysomala regionen, huvudsakligen vRNA, medan Pons (1972) uteslutande isolerade vcRNA från polysa. Det senare bekräftades av observationen att efter tillsats av aktinomycin D, vilket företrädesvis påverkar syntesen av vcRNA (se avsnitt III, B, 1), 2 timmar efter infektion, detekteras inte cfRNA i polysomer av infekterade celler (Pons, 1973).
Genom att använda ett proteinsyntessystem från E. coli och influensavirus vRNA som mall upptäckte Siegert et al (1973) bildandet av viralt NP-protein in vitro. Detta märkta NP-protein karakteriserades av gelutfällning med Ouchterlony-testet. , Kingsbury och Webster (1973) observerade ingen viral proteinsyntes med vRNA med användning av ett proteinsyntessystem härlett från kaninretikulocyter. I samma system upptäckte de dock syntesen av viralt M-protein (om. Kapitel 2) på ett RNA mall isolerad från infekterade celler. Sålunda är det för närvarande omöjligt att svara på frågan om endast viriopisk eller endast komplementär, eller om vissa RNA-fragment av en typ och vissa RNA-fragment av en annan typ används som mallar för proteinsyntes. Därför, för närvarande är det svårt för influensavirus att tillämpa definitionen av en "negativ" eller "positiv" viruskedja, som föreslagits av Baltimore (1971).
B. SYNTES AV VIRALA PROTEINER IN VIVO
Studiet av syntesen av virala "proteiner" underlättas av det faktum att i en infekterad cell ersätts syntesen av cellpolypeptider av virusspecifik syntes. I kycklingembryo fibroblastceller infekterade med HPV (Joss et al., 1969; Skehel, 1972; Klenk, Rott, 1973) och i BHK 2IF-celler infekterade med WSN-stammen av influensavirus (Lasarowitz et al., 1971), till Nästan 4 timmar efter infektion syntetiseras
endast virala proteiner (31). Något tidigare observerade forskare syntesen av tre eller fyra polypeptider i infekterade fästingar (Taylor et al., 1969; Joss et al., 1969; Holland, Kiehn, 1970; White et al., 1970). Därefter upptäcktes andra polypeptider (Lazorowitz et al., 1971; Skehel, 1972; Klenk et al., 1972b; Krug, Etkind, 1973). I allmänhet detekterades alla strukturella β-proteiner i infekterade celler: ett eller två P-proteiner, nukleokapoidsubenheten NP, membranprotein M, hemagglutiniumglykoprotein i oklyvda (HA) och kluvna (HA1 och HA2) former, och NA-subenheten .
Förutom virionproteiner har ett eller två icke-strukturella proteiner (NS) beskrivits.
Det finns märkbara skillnader<в уровнях синтеза отдельных вирусных полипептидов. NP- и NS-полипептиды обычно первыми обнаруживаются в зараженных «летках. Skehel (1973) предположил, что полипептиды Р2, NP и NS, которые первыми обнаруживаются в «клетках, зараженных ВЧП, являются
produkter av RNA-fragment bildade under selektiv transkription av virionpolymeras av tre fragment av det virala genomet. När cellerna infekterades i närvaro av cykloheximid och pulsmärket tillsattes efter avlägsnande av antibiotikumet detekterades endast dessa tre polypeptider. Utifrån detta antogs att RNA-molekylerna för dessa komponenter bildades med hjälp av det introducerade virionlolimeraset under primär transkription. Från den 4:e till den 6:e timmen efter infektion av kycklingfibroblaster med HPV, ökar nivån av M-proteinsyntes, och syntesen av NS-lolileptid minskar (Skehel, 1972, 1973). Nivåer av iolipeptidsyntes kan således kontrolleras individuellt och kan variera under tillväxtcykeln.
Bortsett från klyvningen av HA-polypeptiden till HA1 och HA2, finns det inga bevis för att virusspecifika influensaviruspolypeptider erhålls som ett resultat av klyvning av stora prekursorer (Taylor et al., 1969; Lazarowitz et al., 1971, Skehel 1972; Klenk, Rott, 1973).
Ny information har nyligen erhållits angående lokalisering av virala komponenter i infekterade celler med användning av autoradiografi (Becht, 1971) eller cellfraktionerings- och gelelektroforestekniker (Taylor et al., 1969, 1970). Enligt dessa studier verkar syntesen av alla virala proteiner ske i cytoplasman. Tidigare studier av lokaliseringen av nukleotidantigen genom immunfluorescens tolkades som indikerar att syntes sker i kärnan med efterföljande frisättning av antigenet till cytoplasman (Liu, 1955; Breitenfeld och Schafer, 1957; Holtermann et al., 1960). Det är dock tydligt att immunfluorescens bestämmer ackumuleringen av antigen, och inte dess syntes (se avsnitt IV, B, 2).
1. RNA-polymeras
Virusspecifik aktivitet av RNA-beroende RNA-polymeras kan detekteras i celler infekterade med influensavirus mellan 13 och 3 timmar efter infektion, beroende på vilket cellsystem som används (Scholtissek och Rott, 1969a; Skehel och Burke, 1969; Ruck et al. al., 1969; Mahy, Bromley, 1970). Detta är den första detekterbara virusspecifika aktiviteten efter infektion. Det mesta av den virala lolimerasaktiviteten detekteras i den mikrosomala fraktionen; en del av denna aktivitet finns kvar i kärnorna och kan inte avlägsnas därifrån ens genom intensiv tvätt. Det finns inga fundamentala skillnader i manifestationens kinetik eller i de nödvändiga kofaktorerna mellan nukleära och mikrosomala enzymer (Scholtissek och Rott, 1969a; Mahy et al., 1975).
Vid ytterligare fraktionering av cytoplasman i en stegvis sackarosgradient med användning av metoden enligt Caliguiri och Tamm (1970), detekteras polymerasaktivitet i grova membran (Compans och Caliguiri, 1973; Klenk et al., 1974a).
Eftersom viral polymerasaktivitet har påvisats i renade viruspartiklar (se kapitel 5) uppstår frågan om vilket av de virala proteinerna det kan vara associerat med.Polymeraset som isolerats från celler infekterade med influensavirus renades ungefär 200 gånger. Den enda virusspecifika produkten associerad med polymerasaktivitet var RNP-antigen (NP-protein plus viralt vRNA, bestämt med komplementfixeringsmetoden). Alla försök att avlägsna RNA från detta komplex resulterade i en fullständig förlust av enzymaktivitet (Schwarz och Scholtissek, 1973). P-proteinet lades fram som en kandidat för rollen som viralt polymeras (Kilbourne et al., 1972). När det enzymatiska komplexet, märkt in vivo med aminosyror, isolerades från celler infekterade med influensavirus och renades ungefär 35 gånger, avslöjade elektroforetisk analys initialt endast HP-beloa i detta komplex< (Compans, Caliguiri, 1973). Впоследствии, однако, при других условиях введения;метки удалось обнаружить и Р-белок (Caliguiri, Compans, 1974). С другой стороны, Klenk и соавт. (1974) обнаружили Р-белок в цитоплазматическом золе, "который не обладает полимеразной активностью (Scholtissek, Rott, 1969a; Skehel, Burke, 1969). Эти наблюдения могут означать, что Р-белок осуществляет свою (Предполагаемую активность ферментов только при связывании с РНП-антигеном.
Det är osannolikt att RNP-antigen i sig har polymerasaktivitet, eftersom hyperimmunserum mot RNP-antigen inte hämmar polymerasaktivitet, medan konvalescentserum, som kan innehålla antikroppar mot polymeras, gör det (Scholtissek et al., 1971). Detta konvalescenta serum (som erhölls från djur infekterade med influensa A-virus) hämmade polymerasaktiviteten för alla studerade influensa A-virusstammar, men hämmade inte polymerasaktiviteten hos influensa B-virus. Alla dessa observationer överensstämmer med idén att RNP- antigen (BPHK + NP = protein), kan fungera som en mall för syntesen av cRNA-
2. Nukleokapsidprotein
NP-proteinet binder till det virala RNA:t och bildar RNP-antigenet. Detta gäller för NP-proteinet isolerat inte bara från virion, utan även från den infekterade cellen (Schafer, 1957). "Det kan detekteras för första gången genom att serologiska medel, när
cirka 3 timmar efter infektion, en timme före uppkomsten av hemagglutinin (Breitenfeld, Schafer, 1957). Efter denna tid ökar inte RNP-antigentitern nämnvärt. Detta kan inträffa på grund av en jämvikt mellan ny syntes och inkorporering i mogna partiklar. Genom märkning kan NP-proteinet "detekteras i infekterade celler inom 2 timmar efter infektion (Scholtissek och Rott, 1961; Krug, 1972).
Med hjälp av fluorescerande antikroppar detekteras först RNP-antigen i kärnorna. Senare dyker det upp i cytoplasman (Breitenfeld och Schafer, 1957). Under vissa förhållanden, såsom abortiv infektion (Franklin, Brietenfeld, 1959), i närvaro av p-fluorofenylalanin (Zimmermann, Schafer, 1960), eller under förhållanden av von Magnus-fenomenet (Rott, Scholtissek, 1963), RNP-antigen finns kvar i kärnorna.
Den tidiga ackumuleringen av RNP-antigen i kärnorna hos infekterade celler betyder inte att NP-proteinet också syntetiseras inuti kärnorna. Autoradiografiska studier, såväl som användningen av cellfraktioneringsmetoder, indikerar cytoplasmatisk syntes av detta och ett annat argininrikt protein och deras snabba transport från cytoplasman till kärnorna (Taylor et al., 1969, 1970; Becht, 1971).
I extrakt av infekterade celler innehåller en viss del av RNP-antigenet vRNA (Pons, 1971; Krug, 1972; Krug, Etkind, 1973), även om endast en typ av RNA finns i virala partiklar (vilket följer av frånvaron av någon självhybridisering av vRNA) (Scholtissek, Rott, 1971; Pons, 1971). Det är omöjligt att avgöra om RNP-antigenet som innehåller cfRNA har en specifik roll i processen för virusförökning eller om det bara är en artefakt som uppträder under processen för cellfraktionering. Det visades att båda RNA-strängarna binder lika bra till NP-proteinet in vitro (Scholtissek och Becht, 1971). Således, om det finns något fritt NP-protein och fritt cRNA, bildas motsvarande RNP-antigen omedelbart under homogeniseringsprocessen. Virion-RNA kan ersättas från RNP-antigenet med polyvin "Ilsulfate" M (Pons et al., 1969). Därför kan det testas om utbyte av olika virala RNA i RNP-antigen är genomförbart i cellulära homogenat. Från förändringar i bassammansättningen av viralt RNA märkt under olika tidsperioder med 32P och isolerat från det cytoplasmatiska RNP-antigenet, drar Krug (1972) slutsatsen att en del av cfRNA:t, innan det inkorporeras i RNP-antigenet, existerar i en fri form från NP- ekorre. Inkorporeringen av 32P i RNA från djurvesiklar sker med en betydande fördröjningsfas på grund av den ganska långsamma inkorporeringen av märkt fosfor i x-positionen av nukleosidtrifosfater (Scholtissek, 1965) Tills lämpliga justeringar görs för beräkningar av förändringar i sammansättningen
ingen grund har gjorts, Krugs (1972) uppgifter bör tolkas med försiktighet.
En kinetisk analys av "uppträdandet av RNP-antigen i kärnorna och cytoplasman" utförd av Krug (1972) tyder på att RNP-antigenet som ackumuleras i kärnorna inte är en föregångare till RNP-antigenet som finns i cytoplasman.
3. Icke-strukturella proteiner
Flera icke-strukturella virusspecifika proteiner med okänd funktion har beskrivits för infekterade celler. En av dem, med en relativ molekylvikt på 25 000, som ackumuleras i stora mängder, betecknades NS (Lazarowitz et al., 1971) I polyakrylamidgeler har den en migrationshastighet nära M-proteinets rörlighet. båda proteinerna, verkar vara oberoende av varandra, vilket framgår av skillnaderna i deras peptidkartor. Stora mängder NS-protein finns i kärnorna (Lazarowitz et al., 1971; Krug, Etkind, 1973). Denna information överensstämmer med data från tidigare immunfluorescensstudier av Dim-mock (1969), som observerade "ljus färgning av kärnor med antiserum specifikt för icke-strukturella virala antigener, och denna färgning återspeglade troligen närvaron av NS-protein. Detta protein visade sig också vara det huvudsakliga virusspecifika proteinet i fraktioner av fria och membranbundna ribosomer isolerade från infekterade celler (Pons, 1972; Compans, 1973; Klenk et al., 1974a). Sambandet mellan NS och ribosomer verkar bero på den tonala kraften (Krug och Etkind, 1973). I buffertar med låg jonstyrka adsorberades DENNA nolipatid på båda ribosomala subenheterna, medan den vid tillsats av salt avlägsnades från dem.
En nyligen genomförd studie (Gregoriades, 1973) har ställt vissa tvivel om identifieringen av NS som en icke-strukturell polypeptid skild från virionpolypeptiden M. Det har varit möjligt att extrahera M-polypeptiden från virionen med sur kloroformmetanol och ett protein med identisk elektrofores kan rörlighet också extraheras från hela infekterade celler, -kärnor eller polysomer Analys av produkterna från tryptisk bearbetning av M-proteinet, såväl som nukleära och ribosomassocierade proteiner, ledde till många matchningar, vilket tyder på att M- och NS-proteiner är identiska, men ytterligare information är nödvändig för att ge en övertygande förklaring till dessa resultat.
Utöver NS kan det finnas andra icke-strukturella virusspecifika komponenter, även om ingen av dem existerar. har inte karakteriserats tillräckligt. Använda antiserum riktat mot icke-strukturella virala antigener,
Dimmock och Watson (1969) fällde ut radioaktivt märkta polypeptider från infekterade celler. Elektroforetisk analys i polyakrylamidgel antydde närvaron av flera icke-strukturella polypeptider med en huvudkomponent motsvarande NS. En av de återstående icke-strukturella komponenterna migrerar snabbare och kan motsvara den relativa molekylviktskomponenten på 10 000 till 15 000 som beskrivs av Skehel (1972) och Krug och Etkind (1973).
4. Membran M-protein
M-proteinet, som kantar den inre ytan av lipiddubbelskiktet i höljet och är rikt på virion, finns i relativt små mängder i infekterade celler. Detta antyder inte bara kontrollbarheten av M-proteinsyntes, utan också möjligheten att detta syntes är det hastighetsbegränsande stadiet av virusreproduktion (Lazarowitz et al., 1971) Detta koncept stöds av data att vid en temperatur på 29°C, vid vilken virusproduktionen undertrycks, är M-proteinet det enda virusspecifika protein som inte kan detekteras i infekterade celler (Klenk, Rott, 1973).
M-protein (kan hittas på de släta membranen och plasmamembranen hos infekterade celler (Lazarowitz et al., 1971; Cornpans, 1973a; Klenk et al., 1974a). Dessa data indikerar affiniteten hos detta protein för membran.
5. Hemagglutinin
Hemagglutinin syntetiseras som ett stort glykoprotein - en föregångare till HA, som sedan klyvs till två mindre glykoproteiner: HAi och HA2" (Lazarowitz et al., 1971). Klyvning, som kan undertryckas av proteashämmare (Klenk, Rot, Rott, Klenk, Rott, 1971). ), utförs av uppenbarligen av värdcellens proteolytiska enzymer (Lazarowitz et al., 1973). Graden av klyvning beror på virusets stam, värdcellen, nivån av cytotoxisk effekt och närvaron eller frånvaron av serum i mediet (Lazarowitz et al., 1971, 1973a, b; Klenk, Rott, 1973; Stanley et al., 1973) Således innehåller WSN odlad i en kultur av kycklingembryonfibroblaster endast kluvna hemagglutnin glish-proteiner, medan sådana klyvning är praktiskt taget frånvarande om WSN-virioner odlas i MDBK-celler i frånvaroserum. I närvaro av serum klyvs dock även WSN-hemagglutinin. Klyvning i detta
system sker på plasmamembranet (Lazaro-witz et al., 1973a). I VChP-systemet är mekanismen för sådan uppdelning tydligen annorlunda. Klyvning "uppstår vid intracellulära membran, och plasminogen i detta fall är inte nödvändigt (Shchepk et al., 1974a). Klyvningsgraden minskar kraftigt vid 25 °C (Klenk och Rott, 1973).
HA-klyvning är inte ett krav för hemagglutinerande aktivitet eller virionsammansättning (La-zarowitz et al., 1973a; Stanley et al., 1973), men nyare studier har funnit att det krävs för smittsamhet (Klenk et al., 1975b). Dessa data överensstämmer med hypotesen att HA*, förutom sin roll i adsorptionen, har en annan funktion i infektionsprocessen och att nedbrytning är nödvändig för denna funktion. Baserat på att nedbrytning av HA är ett fenomen som är beroende av " värdcell och att partiklar som innehåller oklyvt HA har låg infektivitet, tyder på att värdområdet och spridningen av influensavirusinfektion är beroende av närvaron av ett värdcellsproteas som ett aktiverande enzym.
I experiment på fraktionering av "letlets infekterade med vi
Rus influensa, fann man att HA-glykoproteiner alltid är
är associerade med membran (Compans, 1973a; Klenk et al.,.
1974a). Intracellulär lokalisering av dessa proteiner och deras moment
walkie-talkie från grova membran till släta endoplasmatiska membran
himmel reticulum och till plasmamembranen kommer att vara de
beskrivs i detalj i avsnitt VII, B. .,
6. Neuraminidas
Viralt NA* som ett aktivt enzym upptäcktes
3 timmar efter infektion i det korioniska allantoismembranet
nakh, och genom extrapolering fastställs att början av dess syn
avhandling sker 1-2 timmar efter infektion (Noll et al.,
1961). Den intracellulära lokaliseringen av NA* studerades med användning av
sedan cellfraktionering, och fann att hon tydligen
mu, liknar lokaliseringen av HA* (Compans, 1973a; Klenk et al.,
1974a). NA* hittades i samband med membran,
erhålls från det släta endoplasmatiska retikulum,
vid bestämning av den genom biologisk aktivitet och genom analys
zu i polyazhrilamidgel. Enzymaktiviteten var hög
dena även i fraktioner som innehåller grova hinnor
oss. Dessa data överensstämmer med data som erhållits från
immunofluorescens (Maeno, Kilbourne, 1970). Efter 4 timmar
efter infektion kan neuraminidas detekteras i cytoplasman
plasma; senare verkar hon koncentrera sig på peri
cell feria.
V. SYNTES AV KOLHYDRATER
Kolhydrater är involverade i bildningen av glykoproteiner och glykolylider av influensavirushöljet (Klenk et al., 1972a). Glykolipider av myxovirus (härstammar från värdcellens plasmamembran (Klenk, Choppin, 1970), men det har inte fastställts vilka som till övervägande del ingår i virion: redan existerande eller nysyntetiserade glykolipider.
Användningen av radioaktiva prekursorer såsom glukosamin, mannos, galaktos och fukos, som är specifikt inkorporerade i virala glukopeltider, har visat att kolhydratsidokedjorna i dessa glykopeptider återsyntetiseras under infektion (Haslam et al., 1970; Cornpans et al., 1970a; Schwarz och Klenk, 1974). Cellfraktioneringsexperiment har gett ytterligare information om platserna för glykosylering av virala glykoproteiner Glukosamin är associerad med HA-polypeptid i både släta och grova cytoplasmatiska membranfraktioner, men fukos är associerad med HA i släta men inte grova membran (Compans, 1973b). .Undertryckning av proteinsyntes med puromycin stoppar nästan omedelbart inkorporeringen av glukosamin, medan fukos fortsätter att inkorporeras i cirka 10-15 minuter (Stanley et al., 1973). Slutligen, i FPV, är glykoproteinet prekursorn för HA och klyvning produkter från HAj<и НА2 содержат, по-видимому, полный состав маннозы « глюкозамина, тогда как содержание фукозы и галактозы значительно выше в продуктах расщепления (Klenk et al., 1975a; Schwarz, Klenk, 1974). Эта наблюдения предполагают, что биосинтез углеводных боковых целей гликопротеинов НА осуществляется по стадиям с различными остатками Сахаров, добавляемыми в разных участках клетки. Глюкозамин и манноза (присоединяются, по-видимому, к полипептидам НА на шероховатых мембранах вскоре после или даже в процессе синтеза поляпептида, в то время как фукоза, вероятно, прикрепляется позже с помощью трансфераз, присутствующих в гладких мембранах.
Dessa glykosyltransferaser är förmodligen cellulära enzymer. Därför bestäms kolhydraten (en del av glykoproteinerna tydligen av värdcellen. Det finns dock bevis för att förutom dessa värdcellsenzymer spelar viralt NA* en betydande roll i bildandet av kolhydratsidokedjor. Det har varit fastställt att ytan på skalen av myceovirus saknar neuraminsyra (Klenk, Choppin, 1970b; Klenk et al., 1970), medan sådana kolhydrater i virusskal som inte innehåller detta enzym är en vanlig komponent (Klenk, Choppin, 1971) ; McSharry, Wagner, 1971; Renkonen et al., 1971) Dessa data tyder på att
Effekten av neuraminsyra är en väsentlig egenskap hos myxovirus. Det visades nyligen att NA* är ansvarig för att ta bort neuraminsyra från influensavirushöljet och därigenom förhindra bildningen av receptorer på virushöljet som annars skulle leda till bildningen av stora aggregat av viruspartiklar (Palese et al., 1974) Dessa data stödjer idén att kolhydratdelen av NA*, som det huvudsakliga ytglykoproteinet, är en produkt av den kombinerade verkan av (cellulära transeferaser och viralt NA*. Tack vare sin verkan kan viruset introducera ett virus- specifik modifiering till (Inledningsvis en värdspecifik, komplex struktur av kolhydratmodifiering, som enligt - uppenbarligen är väsentlig för virusets biologiska aktivitet.
D-glukosamin och 2-deoxi-O-glukos hämmar bildningen av biologiskt aktivt HA*, NA* och infektiöst virus (Kilbourne, 1959; Kaluza et al., 1972). Biokemiska studier har visat att dessa sockerarter konkurrerar med biosyntesen av virala glykoproteiner (Ghandi et al., 1972; Klenk et al., 1972b). I närvaro av dessa hämmare minskar storleken på glykoprotein NA. Reduktionsgraden beror på dosen. Med en ökning av koncentrationen av socker förvandlas således glykoprotein NA med en relativ molekylvikt på 76 000 gradvis till en förening med en molekylvikt på 64 000, vilket betecknades som HA0 (Klenk et al., 1972b; Schwarz och Klenk, 1974). Förskjutningen i molekylvikt är parallell med minskningen av kolhydratinnehåll och HA0-proteinet visade sig vara nästan fritt från kolhydrater (Schwarz) och Klenk, 1974). Dessa resultat indikerar att HAO är en ofullständigt glykosylerad eller "eglykosylerad polypeptidkedja av HA-glykoproteinet och att den hämmande effekten av D-glukosamin a och 2-deoxi-O-glukos beror på skada på glykosylering. HA0-polypeptiden är associerad med membran, som normal HA Den migrerar också från det grova till det släta retikulumet, där den klyvs till polypeptiderna HA01 och HA02. Därför är kolhydrater troligen inte väsentliga för denna polypeptids affinitet för membranet. Frånvaron av hemagglutinerande aktivitet i infekterade celler tyder emellertid på att det icke-glykosylerade proteinet inte kan binda till receptorer.
VI. LIPIDSYNTES
Liksom alla inkapslade virus, förvärvar influensavirus sina lipider genom att återvinna värdcellslipider. Denna ståndpunkt bekräftas av följande observationer:
Denia. Lipidsammansättningen av influensaviruset visade sig vara liknande den hos värdcellen (Ambruster och Beiss, 1958; Frommhagen et al., 1959). Värdcellslipider, radioaktivt märkta före infektion, inkorporeras i virala partiklar (Wecker, 1957). När viruset odlas i olika värdceller detekteras modifieringar av virala lipider (Kates et al., 1961, 1962). I allmänhet återspeglar lipiderna hos virus (som knoppar från cellytan, nära lipidsammansättningen i värdcellens plasmamembran (Klenk, Choppin, 1969; 1970a, b; Renko-nen et al., 1971). nivån av de novo syntesen av fosfolylider i fibroblastceller från kycklingembryon förblev oförändrad i 7 timmar efter influensavirusinfektion, varefter all lipidsyntes undertrycktes (Blough et al., 1973). Denna undertryckning är förmodligen inte en primär effekt, men kan vara sekundärt till i förhållande till hämning av RNA- eller proteinsyntes eller till ”andra biologiska effekter.
Sålunda, baserat på de resultat som hittills erhållits, kan det antas att syntesen av virala lipider sker genom normala cellulära lipidbiosyntetiska processer, och det virala höljet bildas genom inkorporering av lipider från värdcellens plasmamembran.
VII. MONTERING (se även kapitel 2)
A. BILDNING AV NUKLEOCAPSIDER
Som redan nämnts är det mest troligt att nukleokapsidproteinet syntetiseras i cytoplasman. Tydligen är det närvarande där under en kort tid i fri form och associerar sedan med viralt RNA och bildar nukleokapsider (Klenk et al., 1974; Compans och Caliguiri, 1973). Eftersom NP-proteinet snabbt inkorporeras i yaukleokapsider, kan RNA väljas från den reformerade poolen (Krug, 1972). På grund av den lilla storleken av influensavirusnukleokapsider kan de inte exakt identifieras i infekterade celler med hjälp av elektronmikroskopi. Kluster av filament eller fibrer med en diameter av cirka 5 nm observerade i cytoplasman representerar möjligen virala ribonukleoproteiner (Apostolov et al., 1970; Compans et al., 1970b).
Tillgängliga data indikerar att RNA-genomet för influensavirusvirioner består av 5-7 fragment (se kapitel 6).
Därför behöver alla infektiösa partiklar minst en kopia av varje fragment. Hirst (1962) före-
ansåg att nukleokapsider från den intracellulära poolen kan inkluderas i (virioner slumpmässigt. Andelen infektiösa virioner i E-populationen kan ökas genom att inkludera ytterligare RNA-fragment i den genomsnittliga virionen (Compans et al., 1970). Till exempel, om fem krävs för infektiösa olika RNA-fragment, innehåller varje virnoy totalt 7 fragment som ingår i virnoyen slumpmässigt, då bör cirka 22 % av virionerna vara smittsamma. Bevis för den slumpmässiga inkluderingen av RNA-fragment stärktes av de senaste observationerna av Hirst ( 1973) att i en viruspopulation sker rekombination mellan partiklar som inte bildar plack. Sådana partiklars förmåga att delta i rekombination kan förklaras av frånvaron av ett eller flera fragment i partiklarna, där de saknade fragmenten varierar från en partikel. till en annan, så att lämpliga partiklar av ett defekt virus kan bilda rekombinanter.
B. PROCESS FÖR VIRUSBINDNING
Liksom de flesta inkapslade virus, samlas influensaviruset på förformade cellmembran; montering sker genom knoppning från plasmamembranet. Den första demonstrationen av virusfrisättning från cellen genom en process som inte involverar lys tillhandahålls av Murphy och Bang (1952) i tidiga elektronmikroskopistudier av celler infekterade med influensavirus, filamentösa och ■ sfäriska strukturer. Viruspartiklar var inte synliga inuti cellerna under bildandet av infektiöst virus och det var därför tydligt att viruspartiklarna bildades på cellytan.Med ferritinmärkta antikroppar observerade Morgan et al (1961) att cellytan innehöll virus antigen i de områden där viruset bildas Senare elektronmikroskopiska studier visade att ytan på det spirande viruset innehåller samma membran som värdcellen med ett lager av utsprång som motsvarar de virala "spetsarna" på den yttre ytan. På den inre ytan På ytan av det virala membranet finns ett ytterligare elektrontätt skikt frånvarande på cellytan, vilket troligen består av M-olipeptider (Bachi et al., 1969; Compans, Dimmock, 1969; Apostolov et al., 1970).
Elektronmikroskopstudier har gett skäl att ■ föreslå i vilken ordning de virala komponenterna i
associera på cellmembranet (Bachi et al., 1961; Compans och Dimmock, 1969; Compans et al., 1970b).
Virushöljeproteiner uppträder först och ingår i vissa områden av membranet som bör ha normal morfologi; den observerade specifika adsorptionen av erytrocyter på dessa områden av membranet indikerar emellertid närvaron av HA-protein här. Sedan associerar tydligen M-proteinet med den inre ytan av sådana områden av membranet och bildar ett elektrontätt skikt. Därefter binder ribonukleoproteinet specifikt till membranet i dessa områden och knoppningsprocessen sker genom att membranet böjas och sticker ut. segmentet och som omger det associerade ribonukleoproteinet. Polyakrylamidgelelektroforesdata stöder också tanken att höljesproteiner associeras med plasmamembranet snabbare än RNP (Lazarowitz et al., 1971). Värdcellspolypeptider förskjuts från membranet, vilket är en föregångare till virushöljet, eftersom sådana polypeptider inte finns i renade virioner. Som redan nämnts saknas neuraminsyrarester i höljet av spirande influensaviruspartiklar, men finns i angränsande områden av cellmembranet (Klenk et al., 1970) .
Dessa data ger bevis på en dramatisk övergång i kemisk sammansättning mellan höljet av den spirande virala partikeln och det intilliggande cellmembranet.
Men å andra sidan är en viktig egenskap hos spirandeprocessen att det virala höljet är kontinuerligt med värdcellens plasmamembran och är morfologiskt likt det (Compans och Dimmock, 1969). Som nämnts har lipiderna i dessa membran en mycket nära likhet med lipiderna i värdcellmembranet. Dessa observationer tyder på att lipider i det intakta plasmamembranet lätt utbyter med lipider i spirande viruspartiklar genom radiell diffusion.
Följaktligen bildas höljet av det spirande virionet från en liten region av cellmembranet modifierad genom inkluderingen av virionhöljeproteiner. Detta koncept innebär naturligtvis inte behovet av syntes av alla komponenter i membranet vid plasmamembranet.
Det har faktiskt varit känt under lång tid att membranets beståndsdelar måste migrera avsevärda avstånd från en del av cellen till en annan för att ta sig från platsen för deras biosyntes till platsen för membranmontering. Breitenield och Schafer (1957) visade att i celler infekterade med influensavirus kan HA* först ses
förekommer i alla delar av cellen och att den är lokaliserad i den perinukleära zonen i ökad koncentration. Senare ackumuleras HA* i den "perifera regionen" av flare och kan även påvisas i tunna trådar som sticker ut från flare membranet.
Idén att höljeskomponenter migrerar från insidan av cellen till ytan har nyligen bekräftats och utökats genom en serie studier med cellfraktionering och analys av virala proteiner i olika cellfraktioner. Dessa studier tyder också på att HA-glykoproteinet, och möjligen andra höljeproteiner, syntetiseras på det grova endoplasmatiska retikulumet (Compans, 1973a; Klenk et al., 1974). Som avslöjats i puls-chase-experiment, hittas HA efter några minuter i membranen i det släta endoplasmatiska retikulumet (Compans, 1973a; Stanley et al., 1973; Klenk et al., 1974) och i plasmamembranet (Stanley et al. al., 1974). ..., 1973). Även om jaktexperiment från det släta endoplasmatiska retikulumet till plasmamembranet inte har utförts, verkar det troligt att HA migrerar från det grova endoplasmatiska retikulumet till plasmamembranet och går förbi det släta endoplasmatiska retikulumet. Det bör noteras att under hela tiden för sådan migration är HA och andra membranproteiner integrerade delar av membranen längs vilka de rör sig; OBI finns aldrig som lösta proteiner.
I de släta membranfraktionerna, som tros härröra primärt från det endoplasmatiska retikulumet, finns alla större höljesproteiner (Compans 1973a; Klenk et al., 1974). Emellertid skiljer sig deras relativa kvantiteter här från de i plasmamembranet och virion (Stanley et al., 1973; Klenk et al., 1974). Förhållandet mellan M-protein och glykoprotein HA är högre i höljet av den mogna virionen än i membranen i det endoplasmatiska retikulumet. Dessa data tyder på att endast en liten mängd membran som bär HA-glykoproteinet omvandlas till det virala höljet, nämligen membranfraktionerna som innehåller kolhydratfria proteiner. Som redan nämnts kan syntesen av M-proteinet vara det stadium som begränsar processen för virussammansättning.
Skillnaden i synteshastigheten för olika höljeproteiner stöder hypotesen att sammansättningen av höljet är en flerstegsprocess. Detta koncept överensstämmer med frågan om processen för bildning av HA*, inklusive den sekventiella tillsatsen av kolhydratdelen och proteolytisk klyvning under migreringen av den primära genprodukten.
VIII. UTSLÄPP AV FLUSENVIRUS
Problemet med att frigöra influensaviruset från värdcellen,
verkar vara nära relaterat till problemet med viral funktion
NA*, som redan har diskuterats i detalj tidigare (se
fallen V och 2 kap. 4). Det faktum att detta enzym spelar en viktig roll
roll i frisättningen av viruset, som härrör från förmågan hos anti
organ som är specifika för NA* undertrycker sådan frisättning (Se-
till, Rott, 1966; Webster et al. G968). Dessutom sådana antikroppar
förhindra viruseluering från erytrocyter (Brown, Laver,
1968). Bakteriell NA*, som inte hämmas av antikroppar
lami till viralt NA*, kan frisätta viruset från celler,
behandlade med sådana antikroppar (Compans et al., 1969;
Webster, 1970). Å andra sidan tvåvärda antikroppar
till NA orsakar också virusaggregation (Seto och Chang, 1969;
Compans et al., 1969; Webster, 1970), och monovalent anti
kroppar förhindrar inte frisättningen av viruset, även om de hämmar
mer än 90 % av neuraminidasaktiviteten (Becht et al., 1971).
Alla dessa uppgifter tillsammans tyder på det
divalenta antikroppar stör frisättningen av viruset
genom att binda den till antigener som finns på
cellytan, och genom att hämma aktiviteten av enzymer
polis. Rollen av neuraminidas i frisättningen av displayviruset
eller Palese et al. (G974), som konstaterade att denna fer
ment är nödvändigt för att avlägsna neuroamylsyra från vi
rysk yta för att undvika aggregering av virioner - senare -
kov på cellytan.
IX. ABNORMAL FORMER AV REPRODUKTION
A. ABORTIV REPRODUKTION BEROENDE PÅ VÄRDCELLEN
Influensavirus kan infektera en mängd olika värdceller. I många av de infekterade cellerna är emellertid utbytet av infektiös avkomma antingen mycket lågt eller inte detekterbart, även om virala komponenter kan detekteras i normala titrar. Denna typ av värdcellsberoende avbrott i den infektiösa cykeln kallas abortiv infektion. Denna abortiva infektion Infektiös cykel observerades ursprungligen hos möss, infekterade i hjärnan med icke-neurotropa stammar av influensaviruset (Schlesinger, 1953). Ju högre administrerad dos av viruset, desto större mängd nysyntetiserat hemagglutinin. Flera andra värdcell- influensa A-virussystem har beskrivits där endast RNP-^ producerades antigen och hemagglutinin, men inte ett infektiöst virus. I alla dessa ENT-system som hittills studerats ackumulerades RNP-antigenet i kärnan och kunde inte detekteras
beväpnade med hjälp av fluorescerande antikroppar i cytoplasman (Henle et al., 1955; Franklin, Breitenfeld, 1959; Ter Meulen, Love, 1967; Fraser, 1967).
B. VON MAGNUS FENOMEN
Vid seriepassage av influensavirus med en multiplicitet högre än 1 (Barry, 1961) bildas ökande mängder ofullständigt virus som kommer ut från värdcellen (von Magnus, 1951, 1952). Dessa viruspartiklar har en ytstruktur som är mycket lik på strukturen av det infektiösa viruset, är immunogena: och orsakar homolog interferens. De innehåller mindre RNA och RNP-antigen, uppvisar ett lägre förhållande mellan smittsamhet och hemagglutinerande aktivitet och innehåller fler lipider än kompletta viruspartiklar (von Magnus, 1954; Isaacs, 1959; Pauker et al., 1959; Rott och Schafer, 1961; Rott och Scholtissek, 1963).
Vid analys av RNA från ett partiellt virus fann man att viralt RNA med relativt hög molekylvikt antingen saknas eller finns i reducerade mängder, medan mängden RNA med låg molekylvikt ökar (Duesberg, 1968; Pons, Hirst, 1969; Nayak, 1969).
I celler infekterade med den andra outspädda passagen av influensaviruset finns all genetisk information om viruset, eftersom cfRNA isolerat från dessa celler kan omvandla, efter hybridisering, märkt RNA isolerat från det infektiösa viruset till en fullständigt RNA azoresistent form (Scholtissek, Rott , 1969b). Sålunda kan ökningen av mängden lågmolekylärt RNA i ofullständiga partiklar bero på högmolekylärt RNA, som kan inkluderas i dessa partiklar i form av förstörda och därför icke-fungerande molekyler. Denna idé stöds av data om att med en törstig outspädd passage först minskar förmågan att producera infektiöst virus, varefter syntesen av hemagglutinin, neuraminidas och slutligen RNP-antigen minskar (Scholtissek et al., 1966).
Nayak (1972) fann att under den första passagen med hög multiplicitet var viruset som kom upp tidigt helt infektiöst och producerade ett normalt mönster av infektiösa virus-RNA-fragment i sackarosgradienten, medan viruset som kom fram senare hade en RNA-profil som är typisk för en ofullständig ( bakgrund) -Magnus) virus1.
- Dihydrotestosteron hos män - funktion, norm och patologi
- Få insulin: alla de viktigaste sätten
- Hur steroider påverkar prostatakörteln Hur man skyddar prostatan under kursen
- Inte ett virus, inte ett protein, men det heter prion, förkortat prioner
- Rätt näring för magsår
- Terapeutisk ryggmassage för skolios Differentierad ryggmassage 10 15
- Hur man tar bort slem från bronkerna hemma
- Cancerhalsväxt. Snake bergsbestigare. Cancerhalsrot
- Vilka är fördelarna med kombucha?
- Vad är vattusot: typer och behandling
- Linfrön för njurbehandling
- Hur fungerar influensaviruset?
- Överskott av protein: hur skadligt är det?
- Testosteronstandard vid dopingkontroll
- Hur man korrekt använder atropin för komplex behandling Atropin farm action
- Vad är hypogonadism hos män och hur man behandlar denna sjukdom
- Handledsleden är den perfekta motoriska apparaten i den övre extremiteten
- Fosfatidylkolin - fettförbränningsinjektioner
- När är dihydrotestosteron förhöjt hos kvinnor och män?
- Diet för tyreotoxikos i sköldkörteln Vilka livsmedel är inte tillåtna för tyreotoxikos