Gripo viruso replikacija vyksta. Kaip veikia gripo virusas? Gripo virusų identifikavimas naudojant RTG
Jie yra tarpląsteliniai privalomi parazitai, o tai reiškia, kad jie negali daugintis ar perduoti savo genų be pagalbos. Viena viruso dalelė (virionas) pati yra inertiška. Kai virusas užkrečia ląstelę, jis dauginasi naudoja fermentus ir didžiąją ląstelės struktūros dalį.
Skirtingai nuo to, ką matome ląstelių dalijimosi procesuose, tokiuose kaip ir, viruso replikacija gamina daug palikuonių, kurie sunaikina ląstelę-šeimininkę ir užkrečia kitas kūno ląsteles.
Virusinė genetinė medžiaga
Virusai gali turėti viengrandę/dvigrandę DNR arba RNR. Tam tikrame viruse randamos genetinės medžiagos tipas priklauso nuo jo pobūdžio ir funkcijos. Tikslus pobūdis, kas nutinka po šeimininko užsikrėtimo, priklauso nuo viruso pobūdžio.
DsDNR, ssDNR, dsRNR ir vienos grandinės RNR virusų replikacijos procesas skirsis. Pavyzdžiui, dvigrandžiai DNR virusai paprastai turi patekti į šeimininko ląsteles, kad galėtų daugintis. Tačiau vienos grandinės RNR virusai daugiausia dauginasi į ląsteles-šeimininkus.
Kai virusas užkrečia šeimininką, viruso palikuonių komponentus gamina ląstelių mechanizmai, o viruso kapsido surinkimas yra nefermentinis procesas. Virusai paprastai gali užkrėsti tik ribotą skaičių šeimininkų. „Spyna ir raktas“ mechanizmas yra labiausiai paplitęs šio reiškinio paaiškinimas. Tam tikri baltymai ant viruso dalelės turi atitikti tam tikrus receptorių baltymus konkretaus šeimininko ląstelės paviršiuje.
Kaip virusai užkrečia ląsteles?
Pagrindinis infekcijos ir viruso replikacijos procesas vyksta 6 etapais:
- Adsorbcija – virusas jungiasi prie ląstelės šeimininkės.
- Įėjimas – virusas įveda savo genomą į šeimininko ląstelę.
- Viruso genomo replikacija – viruso genomas replikuojamas naudojant šeimininko ląstelių struktūrą.
- Surinkimas – susidaro ir pradeda kauptis virusiniai komponentai ir fermentai.
- Brandinimas – iš surinktų komponentų išsivysto virusai.
- Išeiti – iš šeimininko ląstelės išsiveržia nauji virusai, ieškodami naujų aukų užkrėsti.
Virusai gali užkrėsti bet kokio tipo ląsteles, įskaitant
Ortomiksovirusų šeimai (gr. orthos – teisinga, tukha – gleivės) priklauso A, B, C tipo gripo virusai, kurie, kaip ir paramiksovirusai, turi afinitetą mucinui. A gripo virusais užsikrečia žmonės ir kai kurių rūšių gyvūnai (arkliai, kiaulės ir kt.) bei paukščiai. B ir C tipo gripo virusai yra patogeniški tik žmonėms. Pirmąjį žmogaus gripo virusą iš žmonių 1933 metais išskyrė W. Smith, C. Andrews ir P. Ladow (WS padermė), užkrėsdami baltuosius šeškus. Vėliau šis virusas buvo priskirtas A tipui. 1940 m. T. Francis ir T. Megill atrado B tipo gripo virusą, o 1949 m. R. Taylor atrado C tipo gripo virusą. Klasifikuojant gripo virusus visada iškildavo tam tikrų sunkumų. buvo susidurta su jų antigeniniu kintamumu. Gripo virusai skirstomi į tris tipus A, B ir C. A tipui priklauso keli potipiai, kurie skiriasi vienas nuo kito savo antigenais – hemagliutininu ir neuraminidaze. Pagal PSO klasifikaciją (1980 m.) A tipo žmonių ir gyvūnų gripo virusai skirstomi į 13 antigeninių potipių, pagrįstų hemagliutininu (H1-H13) ir 10 pagal neuraminidazę (N1-N10). Iš jų A tipo žmogaus gripo virusai apima tris hemagliutininus (HI, H2 ir NZ) ir dvi neuraminidazes (N1 ir N2). A tipo viruso hemagliutinino ir neuraminidazės potipis nurodytas skliausteliuose. Pavyzdžiui, A gripo virusas: Chabarovskas/90/77 (H1N1).Struktūra ir cheminė sudėtis
Gripo virusas yra sferinės formos, 80–120 nm skersmens. Rečiau pasitaiko siūlų formos. Sraigtinės simetrijos nukleokapsidė yra ribonukleoproteino (RNP) grandinė, išsidėsčiusi dviguba spirale, kuri sudaro viriono šerdį. Su juo susijusi RNR polimerazė ir endonukleazės (P1 ir P3). Šerdį gaubia membrana, susidedanti iš M baltymo, jungiančio RNP su išorinio apvalkalo lipidiniu dvigubu sluoksniu ir stiloidiniais procesais, susidedančiais iš hemagliutinino ir neuraminidazės. Virionuose yra apie 1% RNR, 70% baltymų, 24% lipidų ir 5 % angliavandenių. Lipidai ir angliavandeniai yra išorinio apvalkalo lipoproteinų ir glikoproteinų dalis ir yra ląstelinės kilmės. Viruso genomą vaizduoja minusinės grandinės fragmentuota RNR molekulė. A ir B tipo gripo virusai turi 8 RNR fragmentus. Iš jų 5 koduoja vieną baltymą, o paskutiniai 3 – po du baltymus.Antigenai
Gripo virusai A, B ir C skiriasi vienas nuo kito tipo specifiniu antigenu, susijusiu su RNP (NP proteinu) ir M-matricos baltymu, stabilizuojančiu viriono struktūrą.Šie antigenai aptinkami RSC. Siauresnį A tipo viruso specifiškumą lemia kiti du paviršiaus antigenai – hemagliutininas H ir neuraminidazė N, žymimi serijos numeriais.Hemagliutininas yra sudėtingas glikoproteinas, turintis apsaugines savybes. Jis skatina organizme virusą neutralizuojančių antikūnų – antihemagliutininų, aptinkamų RTGA, susidarymą. Hemagliutinino (H-antigeno) kintamumas lemia gripo viruso antigeninį dreifą ir poslinkį. Antigeninis dreifas reiškia nedidelius H-antigeno pokyčius, kuriuos sukelia taškinės mutacijos genuose, kurie kontroliuoja jo susidarymą. Tokie pokyčiai gali kauptis palikuoniuose, veikiami selektyvių veiksnių, tokių kaip antikūnai. Tai galiausiai lemia kiekybinį pokytį, išreikštą hemagliutinino antigeninių savybių pasikeitimu. Su antigeniniu poslinkiu įvyksta visiškas geno pakeitimas, kuris gali būti pagrįstas dviejų virusų rekombinacija. Dėl to keičiasi hemagliutinino arba neuraminidazės potipis, o kartais ir abu antigenai, ir atsiranda iš esmės nauji antigeniniai viruso variantai, sukeliantys dideles epidemijas ir pandemijas.Hemagliutininas taip pat yra receptorius, per kurį virusas adsorbuojamas ant jautrių ląstelių. , įskaitant eritrocitus, todėl jie sulimpa ir dalyvauja raudonųjų kraujo kūnelių hemolizėje Virusinė neuraminidazė yra fermentas, katalizuojantis sialo rūgšties skilimą iš substrato. Jis pasižymi antigeninėmis savybėmis ir tuo pačiu dalyvauja išlaisvinant virionus iš šeimininko ląstelės. Neuraminidazė, kaip ir hemagliutininas, keičiasi dėl antigenų dreifo ir poslinkio.Auginimas ir dauginimas
Gripo virusai auginami viščiukų embrionuose ir ląstelių kultūrose. Optimali aplinka – viščiukų embrionai, kurių vaisiaus vandenų ir alantojo ertmėse virusas dauginasi per 36-48 val.Jautriausios gripo virusui yra pirminės žmogaus embrioninių inkstų ląstelių kultūros ir kai kurie gyvūnai. Viruso dauginimąsi šiose kultūrose lydi lengvas CPE, primenantis spontanišką ląstelių degeneraciją. Gripo virusai adsorbuojami ant epitelio ląstelių glikoproteinų receptorių, į kuriuos jie prasiskverbia per receptorių endocitozę. Viruso genomo transkripcija ir replikacija vyksta ląstelės branduolyje. Šiuo atveju nuskaityti atskiri RNR fragmentai m-RNR pavidalu paverčiami ribosomomis, kuriose vyksta virusui būdingų baltymų sintezė. Po viruso genomo replikacijos susidaro virusinių RNR telkinys, kuris naudojamas naujų nukleokapsidų surinkimui.Patogenezė
Pirminis viruso dauginimasis vyksta kvėpavimo takų epitelio ląstelėse. Per erozuotą gleivinės paviršių virusas patenka į kraują, sukeldamas viremiją. Viruso cirkuliaciją kraujyje lydi kraujo kapiliarų endotelio ląstelių pažeidimai, todėl padidėja jų pralaidumas. Sunkiais atvejais pastebimi kraujavimai plaučiuose, širdies raumenyse ir kituose vidaus organuose. Gripo virusai, patekę į limfmazgius, pažeidžia limfocitus, dėl to atsiranda įgytas imunodeficitas, kuris prisideda prie antrinių bakterinių infekcijų atsiradimo.Sergant gripu pasireiškia įvairaus sunkumo organizmo intoksikacija.Imunitetas
Antigripo imuniteto mechanizmas yra susijęs su natūraliais antivirusinės nespecifinės apsaugos veiksniais, daugiausia su interferono ir natūralių žudikų ląstelių gamyba. Specifinį imunitetą užtikrina ląstelinio ir humoralinio atsako veiksniai. Pirmiesiems atstovauja makrofagai ir T-žudikai. Antrieji yra imunoglobulinai, pirmiausia antihemagliutininai ir antineurominidazės antikūnai, turintys virusą neutralizuojančių savybių. Pastarieji, skirtingai nei antihemagliutininai, tik iš dalies neutralizuoja gripo virusą, neleidžia jam plisti. Komplementą fiksuojantys antikūnai prieš viruso nukleoproteiną neturi apsauginių savybių net po 1,5 mėn. išnyksta iš sveikstančiųjų kraujo.Antikūnai kraujo serume aptinkami praėjus 3-4 dienoms nuo ligos pradžios ir maksimalius titrus pasiekia po 2-3 savaičių. Specifinio imuniteto, įgyto užsikrėtus gripu, trukmė, priešingai nei buvo manoma, matuojama keliais dešimtmečiais. Tokia išvada buvo padaryta remiantis sergamumo gripu A (H1N1) viruso sukelto gripo amžiaus struktūros tyrimu 1977 m. Nustatyta, kad šis virusas, kurio nebuvo nuo 1957 m., paveikė tik jaunesnius nei 20 m. Taigi, patyrus gripo infekciją, kurią sukelia A tipo gripo virusas, susiformuoja intensyvus imunitetas, griežtai specifinis jį sukėlusiam viruso potipiui (H- ir N-antigenais), be to, naujagimiai turi pasyvus imunitetas dėl IgG antikūnų prieš atitinkamą viruso potipį A. Imunitetas išlieka 6-8 mėnesius.Epidemiologija
Infekcijos šaltinis yra sergantys žmonės ir viruso nešiotojai. Patogenas perduodamas oro lašeliais. Gripas yra epideminė infekcija, kuri dažniau pasireiškia žiemos ir žiemos-pavasario mėnesiais. Maždaug kas dešimt metų gripo epidemijos tampa pandemijomis, paveikiančiomis skirtingų žemynų gyventojus. Tai paaiškinama A tipo viruso H ir N antigenų pasikeitimu, susijusiu su antigenų dreifu ir poslinkiu. Pavyzdžiui, A gripo virusas su hemagliutininu NSW1 1918 metais sukėlė Ispanijos gripo pandemiją, nusinešusią 20 mln. žmonių gyvybių. 1957 m. „Azijos“ gripo virusas (H2N2) sukėlė pandemiją, kuri paveikė daugiau nei 2 milijardus žmonių. 1968 m. atsirado naujas pandemijos variantas – gripo A (H3N2) virusas, vadinamas Honkongo virusu, kuris cirkuliuoja iki šių dienų. 1977 metais prie jo prisijungė A tipo virusas (H1N1), netikėta, nes identiškas virusas jau cirkuliavo 1947-1957 metais, o vėliau jį visiškai pakeitė „Azijos“ potipis. Šiuo atžvilgiu kilo hipotezė, kad viruso pamaininiai variantai istoriškai nėra nauji. Jie atstovauja pastaraisiais metais cirkuliuojantiems serosotipiams.Gripo viruso, sukėlusio kitą epidemiją, cirkuliacijos nutrūkimas paaiškinamas kolektyviniu gyventojų imunitetu, susiformavusiu šiam antigeniniam patogeno variantui. Atsižvelgiant į tai, atrinkti nauji antigeniniai variantai, kuriems kolektyvinis imunitetas dar nesusiformavęs.Kol kas neaišku, kur pasislinko A gripo viruso antigeniniai variantai (seropotipiai), kurie išėjo iš aktyvios apyvartos vienoje ar ilgą laiką išsaugomas kitas istorinis laikotarpis. Gali būti, kad tokių virusų išlikimo rezervuaras yra laukiniai ir naminiai gyvūnai, ypač paukščiai, kurie yra užsikrėtę A tipo gripo virusų žmonių atmainomis ir ilgą laiką palaiko jų cirkuliaciją. Tuo pat metu paukščių organizme vyksta genetinės paukščių ir žmogaus virusų rekombinacijos, dėl kurių formuojasi nauji antigeniniai variantai.Pagal kitą hipotezę visų žinomų potipių gripo virusai nuolat cirkuliuoja tarp populiacijos, tačiau tampa epidemiškai aktualūs. tik sumažėjus kolektyviniam imunitetui.B ir C tipų gripo virusai pasižymi didesniu antigeniniu stabilumu. B gripo virusai sukelia ne tokias intensyvias epidemijas ir vietinius protrūkius. C tipo gripo virusas yra sporadinių ligų priežastis.Gripo virusą greitai sunaikina aukštesnė nei 56°C temperatūra, UV spinduliuotė, dezinfekavimo ir plovimo priemonės. Jis išlieka gyvybingas 1 dieną. kambario temperatūroje, ant lygių metalinių ir plastikinių paviršių – iki 2 parų. Gripo virusai išgyvena žemoje temperatūroje (-70°C).Specifinė prevencija
Gripo profilaktikai naudojamas rimantadinas, slopinantis A tipo gripo viruso dauginimąsi. Pasyviai profilaktikai naudojamas žmogaus antigripo imunoglobulinas, gaunamas iš donorų, paskiepytų gripo vakcina, kraujo serumo. Žmogaus leukocitų interferonas turi tam tikrą poveikį.Skiepų profilaktikai naudojamos gyvos ir inaktyvuotos vakcinos. Skiepijant gyvomis vakcinomis, susidaro ir bendras, ir vietinis imunitetas. Be to, pastebima interferono indukcija.Šiuo metu yra gautos įvairių tipų inaktyvuotos vakcinos: virioninės, subvienetinės, suskaidytos ir mišrios. Viriono vakcinos gaminamos kokybiškai išgryninant vištų embrionuose išaugintus virusus. Subvienetinės vakcinos yra išgryninti paviršiniai gripo viruso antigenai – hemagliutininai ir neuraminidazė. Tokiems vakcinų preparatams būdingas sumažėjęs reaktogeniškumas ir didelis imunogeniškumas. Suskaldytos arba suirusios vakcinos ruošiamos iš išgrynintos viriono suspensijos apdorojant plovikliais. Tačiau vis dar nėra sutarimo dėl vienos iš šių vakcinų pranašumo. Inaktyvuotos vakcinos sukelia imuninį atsaką bendrojo ir vietinio humoralinio imuniteto sistemoje, tačiau interferono sintezę skatina mažiau nei gyvos vakcinos Ilgametė gyvų ir inaktyvuotų vakcinų naudojimo patirtis rodo, kad vakcinos padermių antigeninis neatitikimas su epidemijos yra pagrindinė, bet ne vienintelė mažo gripo vakcinos profilaktikos veiksmingumo priežastis. Pastaraisiais metais buvo bandoma sukurti genetiškai modifikuotas ir sintetines gripo vakcinas.Gripas
Gripas – ūmi žmonių kvėpavimo takų liga, linkusi plisti epidemiškai. Jam būdingas katarinis viršutinių kvėpavimo takų uždegimas, karščiavimas, sunki bendra intoksikacija. Gripą dažnai lydi sunkios komplikacijos – antrinė bakterinė pneumonija, lėtinių plaučių ligų paūmėjimas.Gripo sukėlėjai priklauso Orthomyxoviridae šeimai. Ji apima trijų tipų virusus – A, B, C. Gripo virusas yra sferinės formos, jo dydis yra 80-120 nm. Kartais susidaro siūliniai virionai. Genomą sudaro vienos grandinės minusinė RNR, susidedanti iš aštuonių fragmentų ir apsupta baltymo kapsidės. RNR, susijusi su 4 vidiniais baltymais: nukleoproteinais (NP) ir didelės molekulinės masės baltymais PI, P2, R3, dalyvaujančiais genomo transkripcija ir viruso replikacija. Nukleokapsidė turi spiralinės simetrijos tipą. Virš kapsido apvalkalo yra matricinio baltymo (M baltymo) sluoksnis. Išoriniame superkapsidės apvalkale yra hemagliutininas (H) ir neuraminidazė (N) spyglių pavidalu. Abu glikoproteinai (N ir H) turi ryškias antigenines savybes. Gripo virusuose rasta 13 skirtingų antigeninių hemagliutinino (NI-13) ir 10 neuraminidazės (N1-10) variantų. Remiantis vidiniu nukleoproteino antigenu, išskiriami trys gripo virusų tipai - A, B, C, kurie galima nustatyti RSC. A tipo virusai, užkrečiantys žmones, turi trijų tipų hemagliutininą (HI, H2, H3) ir dvi neuraminidazes (N1, N2). Atsižvelgiant į jų derinius, išskiriami A gripo virusų variantai - H1N1, H2N2, H3N2. jie nustatomi hemagliutinacijos slopinimo reakcijoje su atitinkamais serumais.Gripo virusai lengvai auginami viščiukų embrionuose ir įvairiose ląstelių kultūrose. Maksimalus virusų susikaupimas vyksta po 2-3 dienų. Išorinėje aplinkoje virusas greitai praranda užkrečiamumą dėl išdžiūvimo. Esant žemai temperatūrai šaldytuve, jis laikomas savaitę, -70 ° C temperatūroje - daug ilgiau. Kaitinant, jis išjungiamas po kelių minučių. Veikiamas eterio, fenolio, formaldehido, jis greitai sunaikinamas.Virusologinis diagnostikos metodas
Medžiaga tyrimams – tamponai iš nosiaryklės, nosies išskyros, kurios paimamos su sausais arba šlapiais steriliais vatos tamponais pirmosiomis ligos dienomis, skrepliais. Virusų galima rasti kraujyje ir smegenų skystyje. Mirtinų atvejų atveju pašalinami pažeistų viršutinių ir apatinių kvėpavimo takų audinių gabalai, galvos smegenys ir kt.. Nosiaryklės tepinėliai imami nevalgius. Pacientas turi tris kartus skalauti skalavimą steriliu natrio chlorido tirpalu (10-15 ml), kuris surenkamas į sterilų plataus kaklo indelį. Po to sterilios vatos gabalėliu nuvalykite galinę ryklės sienelę ir nosies kanalus, tada įmerkite į stiklainį su skalavimu. Medžiagą galite paimti steriliu tamponu, suvilgytu natrio chlorido tirpale, kuris naudojamas kruopščiai nuvalykite galinę ryklės sienelę. Surinkus medžiagą, tepinėlis panardinamas į mėgintuvėlį su fiziologiniu tirpalu, į kurį įpilama 5 % inaktyvuoto gyvūno serumo. Laboratorijoje tamponai išskalaujami skysčiu, prispaudžiami prie mėgintuvėlio šono ir išimami. Drenažas laikomas šaldytuve, kad nusistovėtų, tada vidurinė skysčio dalis surenkama į sterilius mėgintuvėlius. Lydinei mikroflorai sunaikinti į medžiagą dedama antibiotikų penicilino (200-1000 TV/ml), streptomicino (200-500 μg/ml), nistatino (100-1000 IU/ml), 30 minučių palaikoma kambario temperatūroje ir naudojama. izoliuoti virusus.prieš tai patikrinus sterilumą.Jautrus metodas, skirtas išskirti virusus, kurie užkrečia 10-11 dienų amžiaus vištų embrionus. Medžiaga, kurios tūris yra 0,1-0,2 ml, suleidžiama į amniono arba alantoiso ertmę. Paprastai užkrėsti 3-5 embrionai. Embrionai inkubuojami optimalioje 33–34 °C temperatūroje 72 valandas. Siekiant padidinti virionų skaičių tiriamojoje medžiagoje, ji iš anksto koncentruojama. Tam jie naudoja virusų adsorbcijos ant vištų raudonųjų kraujo kūnelių metodus, apdoroja 0,2% tripsino tirpalu, siekiant sustiprinti virusų infekcines savybes, arba specialiais metodais nusodina juos. Po inkubacijos viščiukų embrionai atšaldomi 4 °C temperatūroje 2-4 valandas, po to steriliu pipetėmis arba švirkštu išsiurbiamas alantojo arba amniono skystis. Šiuo atveju infekcinio viruso buvimas nustatomas naudojant RGA. Norėdami tai padaryti, sumaišykite vienodus kiekius (0,2 ml) virusui atsparios medžiagos ir 1% vištienos raudonųjų kraujo kūnelių suspensijos. Apie teigiamą reakciją (viruso buvimą medžiagoje) rodo eritrocitų nusėdimas skėčio pavidalu.Jei medžiagoje yra hemagliutininių savybių turintis virusas, jis titruojamas naudojant išplėstinį RGA, nustatant hemagliutininio aktyvumo titras. Naudojant šią reakciją, nustatomas hemagliutinacijos viruso titras – didžiausias medžiagos praskiedimas, vis dar sukeliantis hemagliutinacijos reakciją. Šis viruso kiekis laikomas vienu hemagliutininiu vienetu (HAU).Gripo virusų identifikavimas naudojant RTGA
Norėdami tai padaryti, pirmiausia paruoškite virusinės medžiagos darbinį skiedimą, kuriame tam tikrame tūryje yra 4 GAO viruso. Į reakciją atsižvelgiama susidarius eritrocitų nuosėdoms kontroliniuose šuliniuose. Apie teigiamą reakciją rodo hemagliutinacijos uždelsimas tyrimo duobutėse.Gripo virusus galima išskirti naudojant įvairias ląstelių kultūros linijas – žmogaus embrionų, beždžionių inkstus, ištisinę šunų inkstų ląstelių liniją (MDCK) ir kt. Ląstelių kultūrose pasireiškia citopatinis virusų poveikis (atsiranda ląstelių su šukuotais kraštais, vakuolėmis, susidaro intrabranduoliniai ir citoplazminiai intarpai), kuris baigiasi ląstelės vienasluoksnio degeneracija.Išskirtiems virusams identifikuoti naudojamas RTGA. (su sąlyga, kad hemagliutinino titras kultūros skystyje yra ne mažesnis kaip 1:8). Be šios reakcijos, galite naudoti RGGads, tačiau ji yra mažiau jautri ir reikalauja, kad imuninio serumo titras būtų bent 1:160, taip pat RSK, RN, REMA ir kt.Serologinis tyrimas
Serologinis tyrimas naudojamas gripo diagnozei patvirtinti. Jis pagrįstas keturis kartus padidėjusio antikūnų titro paciento serume nustatymu.Pirmasis serumas gaunamas ligos pradžioje ūminiu periodu (2-5-1 ligos diena), antrasis - po 10- 14 ligos diena. Kadangi serumus galima maišyti vienu metu, pirmasis iš jų laikomas šaldytuve -20 ° C temperatūroje. Dažniausiai naudojami RTGA, RSK, RNGA. Šios reakcijos atliekamos naudojant specialius standartinės virusinės diagnostikos rinkinius (įvairių serologinių tipų gripo viruso etaloninės padermės). Kadangi pacientų serumuose gali būti nespecifinių hemagliutinacijos inhibitorių, jie pirmiausia kaitinami 56 °C temperatūroje ir taip pat apdorojami specialiu fermentu (pavyzdžiui, neuraminidaze) arba kalio perjodato, rivanolio, mangano chlorido, baltos padangos suspensijos ir kt. pagal specialias schemas. IRHemagliutinacijos slopinimo reakcija
Hemagliutinacijos slopinimo reakcija gali būti atliekama mėgintuvėliuose (macromsh tod) arba specialiose plokštelėse imunologiniams tyrimams.Reakcija laikoma teigiama, kai susidaro kompaktiškos, tankios raudonųjų kraujo kūnelių nuosėdos lygiais kraštais.Ekspresinė diagnostika
Metodas pagrįstas specifinių viruso antigenų identifikavimu tiriamojoje medžiagoje, naudojant imunofluorescenciją tiesioginiame arba netiesioginiame RIF. Gleivės paimamos iš nosies kanalų arba galinės ryklės sienelės, centrifuguojamos, o iš gleivinės stulpinių epitelio ląstelių nuosėdų ant stiklinių stiklelių ruošiami tepinėliai. jie yra apdorojami imunofluorescenciniais serumais, konjuguotais su fluorochromais, pavyzdžiui, FITC (fluoresceino izotiocianatu). Tiriant vaistus fluorescenciniu mikroskopu, pastebimas būdingas žaliai geltonas gripo virusų švytėjimas, kurie ligos pradžioje lokalizuojasi epitelio ląstelių branduoliuose, pastaruoju metu siūloma naudoti ELISA, RZNGA, PGR. nurodyti specifinius viruso antigenus.Adsorbcija
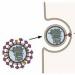
Garsusis „H5N1“ reiškia „penkto tipo hemagliutininas, pirmojo tipo neuraminidazė“ – šie du baltymai išsikiša ant gripo viruso paviršiaus (1 pav. hemagliutininas yra žalias, o neuraminidazė – pilka).
Hemagliutinino pagalba gripo virusas prisitvirtina prie receptorių ląstelių paviršiuje. Pradinis viruso taikinys yra kvėpavimo takų blakstieninio epitelio ląstelės, bet ne dėl to mes jį mėgstame: hemagliutininas gali prisijungti prie daugelio kitų ląstelių, įskaitant raudonuosius kraujo kūnelius, receptorių. Jei vienas virusas vienu metu prisijungia prie dviejų (greta esančių) raudonųjų kraujo kūnelių, raudonieji kraujo kūneliai sulips! Iš čia ir kilo baltymo pavadinimas – „kraujo klijavimas“.
ryžių. 1
Įgyvendinimas
Kvaila ląstelė sugeria virusą, kuris prie jos prisitvirtino fagocitozės būdu – kaip ir suvalgo jį. Kodėl, kodėl vaikai vis kiša į burną visokių bjaurių dalykų?! Tačiau virusas vis dar yra ląstelės viduje kaip maistas, fagocitozės pūslelės viduje (2 pav. – „endosoma“). Endosoma susilieja su lizosoma, susidaro virškinimo vakuolė, į ją pumpuojami protonai iš citoplazmos, kad susidarytų rūgštinė aplinka (šis procesas parodytas 2 pav.) – dar šiek tiek, ir mes suvirškinsime virusą (su žodžiai „baltyminis maistas, koks skirtumas“).

ryžių. 2
Juostelė
Tačiau virusas yra pasirengęs tokiai įvykių eigai:
 ryžių. 3 |
- Hemagliutininas modifikuojamas veikiamas rūgščios aplinkos – jo paviršius tampa hidrofilinis, ir jis (anksčiau prisirišęs prie receptorių vidiniame endosomos membranos paviršiuje, dabar) įterpiamas į šios membranos vidų.
- Protonai, pumpuojami į endosomą, pereina specialių kanalų baltymus (M2 baltymus, nurodytus 1 ir 3 pav.) per lipidinį viruso apvalkalą ir pasiekia baltyminį viruso apvalkalą (1 pav. - baltų rutuliukų ratas - M1 baltymai). Dėl to baltyminis apvalkalas sunaikinamas (3 pav. sunaikinto baltyminio apvalkalo M1 baltymai pažymėti raudonomis žvaigždutėmis).
- Viruso lipidinis apvalkalas (dėl skvarbaus hemagliutinino veikimo) susilieja su fagosomos (lipidine) membrana; Viruso RNR patenka į ląstelės citoplazmą.
Viruso replikacija
Pati viruso RNR, patekusi į citoplazmą, yra visiškai saugi.
- Baltymų ant jo pasigaminti negalima, nes tai yra minus RNR (baltymus koduoja ne ji, o papildoma pliusinė grandinė, kurios dar nėra).
- Ant jo taip pat neįmanoma pagaminti RNR – mūsų ląstelės paprastai neturi fermento, galinčio padvigubinti RNR.
„O-ho-ho, tu nieko neturi“, – niurzga gripo virusas, purtydamas ūsuotą galvą, – bet viskas gerai, aš viską atsinešiau. Virusas atsinešė baltymus PB1, PB2 ir PA, kurie kartu sudaro nuo viruso RNR priklausomą RNR polimerazę – ji gali dubliuoti RNR. Bet nesiseka! Bet kuriai polimerazei reikia grunto, kad ji pradėtų veikti, bet užmaršusis gripas jo nepasiėmė! Viskas baigėsi?!
Nusiramink, nepanikuokite! – Šiais žodžiais visa kompanija (8 viruso RNR ir 3 viruso fermentai) siunčiama į ląstelės branduolį. Ten gripas gauna visas paslaugas:
- virusinės RNR replikacijos pradmenys (norint gauti plius RNR) yra sekcijos, atskirtos nuo ląstelinės RNR;
- apdorojimas: sekcijos, kurios tarnavo kaip RNR sintezės pradmenys - tai buvo dangteliai, todėl 5" galo modifikavimas buvo atliktas pačioje pradžioje; sintezės pabaigoje įvyksta 3" galo poliadelacija;
- sujungimas: kai kurios virusinės RNR, turinčios informacijos apie du baltymus, supjaustomos į dvi dalis.
Tokiu būdu sintetinamos plius RNR, kurios gali būti šablonai virusinių baltymų ir virusinių minus RNR sintezei.
Tada viskas paprasta: kvaila ląstelė, naudodama savo ribosomas iš savo aminorūgščių, sintezuoja viruso baltymus, įskaitant nuo RNR priklausomą RNR polimerazę. Gripas atėmus RNR taip pat aktyviai gaminamas branduolio viduje. Viruso dalelės susirenka citoplazmoje, vidiniame ląstelės membranos paviršiuje. Užbaigtas virusas palieka ląstelę egzocitozės (bumzavimo) būdu, neuraminidazė įkanda paskutinį siūlą, jungiantį ląstelę ir naujagimį virusą... Į pasaulį išeina nauja (pikta) gyvybė!

ryžių. 4
K. SOLTISSEK ir H.-D. KLENKAS (SN. SCHOLTISSEK, H.-D. KLENK)
I. ĮVADAS
Yra daugybė apžvalgų apie gripo viruso dauginimosi problemą. Literatūra iki 1968 m. apibendrinta Hoyle'o (1968) ir Scholtisseko (1969) straipsniuose; naujesni darbai apima White'o (1973) ir Companso ir Choppino (1974) apžvalgas.
Daugiausia duomenų apie replikaciją gauta tiriant A tipo gripo virusą. Reikšmingi kitų tipų gripo virusų replikacijos mechanizmų skirtumai dar nenustatyti.
Plačiai paplito kelios ląstelių kultūros sistemos, patogios tirti replikaciją, pavyzdžiui, gripo viruso WSN padermės dauginimąsi MDBK ląstelėse (Choppin, 1969) arba paukščių maro viruso (FPV) dauginimąsi viščiukų embriono fibroblastų ląstelėse. Paskutinio viruso augimo kreivės per vieną ciklą pavyzdys buvo įrodytas 30, kur latentinis laikotarpis yra maždaug 3 valandos, o viruso gamyba pasiekia plato tarp 8 ir 12 valandų. Apskritai tokiose ląstelių sistemose didelis derlius stebimas infekcinio viruso kiekis, o po infekcijų labai efektyviai slopinama ląstelių baltymų sintezė. Todėl tokios sistemos labai patogios biocheminiams tyrimams.
II. VIRUSO ADSORBCIJA, PASVEIKIMAS, „NUŠALINIMAS“.
Ląstelės užkrėtimas virusu prasideda nuo adsorbcijos, t.y. viruso dalelės prisitvirtinimo prie ląstelės paviršiaus. Prisirišimui reikalingos dvi viena kitą papildančios struktūros, būtent: receptorių vietos ląstelės paviršiuje ir viruso komponentas, atsakingas už šių receptorių vietų atpažinimą.Gripo viruso gebėjimas sąveikauti su įvairios kilmės eritrocitais ir juos agliutinuoti žinomas jau daugelį metų (Hirst, 1941; McClelland, Hare, 1941) Hemagliutinacija buvo naudojama kaip pavyzdinė gripo viruso sąveikos su ląstelės paviršiumi reakcija, ir „dauguma jūsų žinių apie šį reiškinį gaunama iš panašių tyrimų. Tačiau apibendrindami reikia būti labai atsargiems, nes eritrocitų paviršiaus ir infekuotų ląstelių paviršiaus struktūros gali visiškai skirtis (taip pat žr. 3 skyrių).
A. HEMAGLUTIININO VAIDMUO ADSORPCIJOJE
Viriono komponentas, dalyvaujantis surišant, yra HA* „smaigalys“. Viruso β-baltymų vaidmuo inicijuojant infekciją buvo tiriamas naudojant antikūnus, būdingus dviem paviršiaus baltymams: HA* ir NA*. Šiuos antikūnus galima gauti naudojant rekombinantinius virusus. Pavyzdžiui, dėl AO ir A2 virusų kryžminimo susidaro rekombinantinis X7F1, turintis HA*, AO ir NA* A2 (Kilbourne ir kt., 1968). Antiserumas prieš X7F1 virusą neslopina AO tipo gripo virusų NA*, bet slopina hemagliutinaciją ir neutralizuoja šio tipo virusų užkrečiamumą. To paties serumo sąveika su gripo A2 virusais neslopina hemagliutinacijos ar užkrečiamumo, nors NA* aktyvumas yra visiškai neutralizuojamas. Taigi, NA* nedalyvauja infekcijos inicijavimo procese, ir tik NA* yra atsakinga už adsorbciją. Šią koncepciją patvirtina duomenys, kad virusinės dalelės, iš kurių proteolitiniai fermentai pašalino tik neuraminidazės „spygliukus“, išliko užkrečiamos (Schulze, 1970).
Yra įrodymų, kad hemagliutinuojanti dalis yra išorinėje HA* „smaigalio“ dalyje, kurioje gausu angliavandenių (žr. 3 skyrių). Atrodo, kad angliavandeniai yra būtini HA* funkcijai, nes neglikozilinti HA* baltymai negali prisijungti prie raudonųjų kraujo kūnelių (Klenk ir kt., 1972b).
B. GRIPO VIRUSŲ RECEPTORIAUS
Angliavandeniai yra esminis ne tik hemagliutinino, bet ir viruso receptoriaus, esančio ląstelės paviršiuje, komponentas.Hirst (1942) pastebėjo, kad viruso-eritrocitų kompleksas yra nestabilus, o ląstelės paviršiuje esantį receptorių sunaikina viruso fermentas. Kaip vėliau buvo parodyta, šis fermentas yra neuraminidazė, kuri skaido neurastinę rūgštį iš glikoproteinų (Klenk ir kt., 1955; Klenk, Stoffel, 1956; Gottschalk, 1957). Tai buvo pirmasis fermento, kuris yra neatskiriama dalis, demonstravimas. Bakterijų neuraminidazės taip pat gali sunaikinti gripo viruso receptorius (Burnet, Stone, 1947). Taigi buvo nustatyta, kad gripo viruso receptorius yra glikoproteinas, turintis neuramino rūgšties.
Nuo tada sukaupta daug informacijos
apie miksoviruso receptorių, neseniai apibendrinta apžvalgoje
Hughesas (1973). Gauti duomenys trumpai apibendrinami taip:
pučiantis Receptorių srityse yra neuromių liekanų.
jono rūgštis, kurios yra angliavandenių grandinėse
glikoproteinai. Neoksiduojančios galinės neuromio liekanos
nosnla yra būtini glikoproteinų sąveikai su virusais
Rusų gripas. Gydymas neuraminidaze visiškai pašalina
surišimo veikla. Degradacijos tyrimai su yra
naudojant periodatą daroma prielaida, kad sujungimui
veiklai reikalinga nepažeista neuramino molekulė
rūgštys (Suttajit ir Winzler, 1971). karboksilo grupė,
tikriausiai taip pat vaidina svarbų vaidmenį, nes tai būtina
matyt, ir elektrostatinės jėgos (Huang, 1974).
Panašu, kad čia tik silpnas prieskonis
fiziškumas, palyginti su struktūra, su kuria jis yra susijęs
neuramino rūgštis, nes buvo įrodyta, kad visa tai
glikoproteinų rinkinys, kuriame yra jaeuramino rūgšties,
jungiasi su miksovirusais. Be to, gangliozidai (gli-
šiuo atžvilgiu yra aktyvūs (Haywood, 1975).
Tikimasi, kad gripo viruso prisijungimo klausimas taps aiškesnis, kai bus nustatyta receptoriaus molekulinė struktūra. Tam tikru mastu tai jau buvo pasiekta eritrocitų atveju (Marchesi ir kt., 1973). Papildomos informacijos taip pat galima gauti tiriant miksovirusų prisirišimą prie dirbtinių membranų (Tiffany ir Blough, 1971).
B. GALIMI PASVEIKIMO IR „NUDUOLINIMO“ MECHANIZMAI
Buvo pasiūlyti du skirtingi ne tik gripo viruso, bet ir apskritai virusų, turinčių išorinį apvalkalą, „siskverbimo ir „nurengimo“ mechanizmai. Abu požiūriai daugiausia grindžiami elektronų mikrotranšėjos tyrimais. Vienas iš šių mechanizmų yra vironexis, kuris, kaip manoma, yra ppnocitozės procesas, kai viruso dalelės patenka į pinosomas, kurios vėliau susilieja su lizosomomis, o lizosomų fermentai sukelia viruso „nusirengimą“ (Fazekas de St. Grot, 1948). Elektronų mikroskopinis patvirtinimas Šis požiūris buvo gautas Dales ir Choppin (1962) bei Dourmashkin ir Tyrrell (1970) darbuose. Praėjus 10 minučių po užsikrėtimo, viruso dalelės buvo matomos tiesioginiame sąlytyje su ląstelės paviršiumi, o po 20 minučių dalelės buvo matomos. rasta citoplazminių vakuolių viduje. Priešingai nei šis Morgan ir Rose (1968) tyrimas rodo, kad virusas gali patekti į virusą susiliejus su ląstelės šeimininko membrana.Todėl šiuo metu nėra sutarimo dėl gripo viruso patekimo mechanizmo.
Kaip aprašyta sk. 5, gripo viruso virionuose yra RNR polimerazės, susijusios su jų ribonukleoproteinų komponentais. Todėl mažai tikėtina, kad „nusirengimo“ procesas būtų erdviškai atskirtas nuo ribonukleoproteino išsiskyrimo proceso. Ir ši stadija vyksta ląstelės paviršiuje, pagal mechanizmą membranos susiliejimas ir fagocitinėse pūslelėse, atsižvelgiant į virohexis mechanizmą.
III. TRANSKRIPCIJA A. RNR SINTEZĖS SEKA
Po „nusirengimo“ viriono sRNR turi būti transkribuota į komplementarią RNR.RNR polimerazė, įvesta kartu su užkrečiančia dalele, turi veikti pirmajame viruso dauginimosi etape (žr. 5 skyrių). Gripo viruso genomą iš virionų galima išskirti tik forma
atskiri fragmentai (žr. 6 skyrių). Be to, jis veikia atskirų fragmentų pavidalu, kaip parodė genetinė analizė (7 skyrius) ir laipsniškas infekcinio viruso inaktyvavimas (Scholtissek, Rott, 1964). Šiuo atžvilgiu reikėtų manyti, kad polimerazė inicijuoja sintezę. RNR kiekviename atskirame fragmente Kadangi RNR ląstelėje neegzistuoja kaip laisva molekulė, o visada yra apsirengusi baltymu, kyla klausimas: su kokiu baltymu virusinė RNR yra susijusi replikacijos metu?
Eksperimentai, atlikti siekiant ištirti gripo viruso RNR sintezę, kelia didelių sunkumų, nes aktinomicinas D negali būti naudojamas virusinės RNR gamybai nustatyti, kai jis specifiškai slopina ląstelių RNR sintezę, nes šis antibiotikas slopina gripo viruso dauginimąsi ( Barry ir kt., 1962; Rott, Scholtissekas, 1964; Barry ir kt., 1965; Pons, 1967). Dėl šios priežasties, norint nustatyti RNR sintezės laiko seką, buvo naudojama specifinė impulsu pažymėtos RNR hibridizacija įvairiuose taškuose po užsikrėtimo nepažymėtos vRNR arba vcRNR pertekliumi, o po to buvo atliktas gydymas RNaze (Scholtisek ir Rott, 1970). Ankstyvosiose infekcinio ciklo stadijose vyravo vcRNR sintezė, maksimumą pasiekusi maždaug antrą valandą po užsikrėtimo, o vėlesnėse stadijose didžioji dalis virusui būdingos RNR buvo pagaminta vRNR. Krug (1972), naudodamas kitą metodą, taip pat parodė, kad praėjus 4 valandoms po užsikrėtimo, BIKRNR sintezė beveik visiškai nutrūksta. Po fenolio ekstrahavimo aptinkamas palyginti nedidelis lncRNR kiekis (Scholtisek ir Rott, 1970).
Dėl to, kad vienas ar kitas viruso RNR tipas turi informacinį1!! veikia ir yra naudojamas kaip viruso baltymų sintezės šablonas (žr. IVA skyrių), viruso RNR diferencinio katabolizmo lygiu gali būti tam tikra transliacijos kontrolė. Todėl buvo atlikti pulso persekiojimo eksperimentai, siekiant ištirti gripo viruso RNR stabilumą in vivo. Nustatyta, kad, priešingai nei ląstelių RNR, abu virusinės RNR tipai yra visiškai stabilūs per 90 dienų laikotarpį (Scholtisek ir kt., 1972).
Anksčiau tirdami virusinės RNR sintezę in vivo, kai vėlyvose infekcinio ciklo stadijose buvo pridėta aktinomicino D (Duesberg ir Robinson, 1967; Nayak, 1970; Ma-hy, 1970), jie neatsižvelgė į tai, kad antibiotikas specifiškai slopina komplementarios RNR sintezę in vivo (Scholtisek ir Rott, 1970; Pons, 1973). Kadangi lncRNR išsiskiria iš užkrėstų ląstelių mažiausiai penkių atskirų fragmentų pavidalu, buvo padaryta išvada, kad virusinė RNR taip pat sintetinama fragmentų pavidalu (Pons ir Hirst, 1968).
B. VIRUSINĖS RNR SINTEZĖS LOKALIZACIJA LĄSTELĖS ŠEMĖNĖJE VIDUJE
Remiantis autoradiografijos būdu gautais duomenimis, buvo padaryta išvada, kad viruso RNR sintezės vieta yra ląstelės branduolys (Scholtisek ir kt., 1962; Barry ir kt., 1974). Kadangi pulso periodai, naudojami šiuose tyrimuose, vis dar buvo per ilgi, negalima atmesti galimybės, kad virusinė RNR sintetinama ląstelės citoplazmoje ir vėliau transportuojama į branduolį, kur gali kauptis. Be to, vRNR ir cRNR gali būti sintetinami skirtingose ląstelės vietose.
B. VIRUSINĖS RNR SINTEZĖS slopinimas 1. Aktimomicinas D, mitramicinas ir a-amanitinas
Kai DNR šablono funkcijai trukdančių aktinomicino D arba mitramicino dedama į užkrėstas ląsteles tuo metu, kai jau yra nuo viruso RNR priklausoma RNR polimerazė (pavyzdžiui, praėjus 2 valandoms po užsikrėtimo), vRNR sintetinama dar maždaug 2 valandas. Tačiau VcRNR gamyba iš karto sustoja. Vėliau vRNR sintezė taip pat mažėja, o tai rodo, kad tam reikalingas nuolatinis vRNR susidarymas (Rott ir kt., 1965; Scholtissek ir Rott, 1970; Scholtissek ir kt., 1970; Pons, 1973). Gregoriades (1970) parodė, kad aktinomicinas D taip pat turi stiprų poveikį vRNR sintezei, kai pridedamas vėlyvoje infekcijos ciklo dalyje. Šiuose eksperimentuose virusinės RNR sintezę lėmė padidėjęs žymėto uridino įsijungimas į bendrą užkrėstų ląstelių RNR. Šį padidėjimą galima pašalinti pridedant aktinomicino D. Tačiau reikia turėti omenyje, kad gripo viruso infekcija padidina žymėto uridino įsisavinimą į ląstelę po užsikrėtimo (Scholtissek ir kt., 1967) ir kad aktinomicinas D turi slopinamąjį poveikį šiam įsisavinimui (Scholtissek ir kt., 1967). .., 1969). siAmanitinas, neturintis afiniteto DNR, veikia vienos iš ląstelinių RNR polimerazių (RNR podimerazės II) aktyvumą, taip pat slopina cRNR sintezę, kai įdedamas į kultūros skystį iš karto po užsikrėtimo (Rott ir Scholtissek, 1970; Mahy ir kt. al., 1972).
Specifinio šių antibiotikų cfRNR sintezės slopinimo mechanizmas nėra iki galo aiškus, nes jie neturi įtakos cfRNR susidarymui in vitro, todėl šie antibiotikai veikia tik in vivo, nors fermentą, sintetinantį cfRNR, galima išskirti iš ląstelių, į kurias patenka. Praėjus 2 valandoms po užsikrėtimo, buvo pridėta aktinomicino D (Scholtisek ir Rott, 1969a).
Gripo virusų dauginimąsi taip pat gali slopinti kitas poveikis ląstelės-šeimininkės DNR – mitomcino C įvedimas, išankstinis apdorojimas ultravioletiniais spinduliais arba ląstelių branduolių pašalinimas prieš infekciją (Barry, 1964; Rott ir kt., 1965; Nayak, Rasmussen, 1966; Fol-Lett ir kt., 1974; Kelly ir kt., 1974). Mechanizmas, kuriuo šis poveikis veikia gripo viruso replikaciją, gali būti toks pat kaip ir kitų antibiotikų veikimo mechanizmas. Vienintelė prielaida, kurią galima daryti iš šių tyrimų, yra ta, kad reikia „funkciškai“ aktyvių ląstelių branduolių ir arba) nuo DNR priklausomos ląstelės funkcijos, skirtos gripo virusų dauginimui. Neįmanoma pasakyti, kokios tai funkcijos.
2. Cikloheksimidas
Kai cikloheksimidas, kuris specifiškai slopina baltymų sintezę gyvūnų ląstelėse, pridedamas praėjus 2 valandoms po užsikrėtimo gripo virusu, vRNR susidarymas iš karto sustoja, o vRNR formavimasis tęsiasi mažiausiai 2 valandas (Scholtisek ir Rott, 1970; Pons. , 1973). Kol kas nežinoma, ar reikalinga nuolatinė viruso arba ląstelinio baltymo, naudojamo kaip „vRNR sintezuojančios polimerazės kokybė / kofaktorius“, sintezė, ar reikalingas tam tikras „baltymas (pvz., NP baltymas), norint stabilizuoti naujai susintetintą vRNR, arba specifinio viruso baltymo sintezės slopinimas veda prie nuolatinio cRNR susidarymo, kurio sintezė paprastai išjungiama praėjus 3 valandoms po užsikrėtimo. Šio išjungimo gali prireikti norint suaktyvinti vRNR sintezę. Tyrimai su temperatūrai jautriais mutantais turėtų atsakyti į kai kuriuos iš šių klausimų.
Bean ir Simpson (1973) eksperimentai parodė, kad cikloheksimidas neslopina pirminės transkripcijos in vivo (cRNR sintezė RNR šablone naudojant užkrečiančios dalelės polimerazę), o aktinomicinas D visiškai slopina transkripciją. Taigi cikloheksimidas neveikia in vivo su infekcine dalele įvestos ir cfRNR sintetinančios polimerazės aktyvumo, tačiau slopina naujos polimerazės, reikalingos cfRNR gamybai, sintezę.
3. Gliukozaminas
Yra žinoma, kad gliukozaminas išeikvoja UTP telkinį viščiukų embrionų ląstelėse, sudarydamas UTP-]M-acetilgliukozaminą (Scholtissek, 1971). Kai Earl tirpalas, kuriame yra gliukozės, naudojamas kaip auginimo terpė, tai
turi įtakos tik virusinių glnkoproteinų sintezei (žr. V skyrių). Tačiau jei gliukozė, kaip energijos šaltinis, pakeičiama liruvatu arba fukoze, UTP baseinas dėl šių amino cukrų išeikvojamas maždaug 10 kartų aktyviau. Tokiomis sąlygomis ląstelės-šeimininkės UTP telkinys tampa specifiniu vRNR sintezės greičio ribotuvu, o ląstelinės RNR sintezė dar nėra paveikta (Scholtisek, 1975). Dėl virusinės RNR sintezės slopinimo taip pat nėra virusinių baltymų susidarymo.
Šiuos duomenis galima interpretuoti dviem būdais: arba nuo viruso RNR priklausoma RNR polimerazė turi mažą afinitetą UTP, palyginti su nuo ląstelių DNR priklausomomis ir RIC polimerazėmis, arba ląstelėje yra du daugiau ar mažiau nepriklausomi UTP telkiniai, vienas iš kuris gali būti naudojamas virusinei RNR sintezei ir yra labiau paveiktas gliukozamino nei kitas telkinys, kurį RNR polimerazės gali naudoti kaip substratą.
D. VIRUSINĖS RNR SINTEZĖ IN VITRO
Ląstelėse, užkrėstose gripo virusu, keli mokslininkai atrado nuo RNR priklausomą RNR polimerazę (Ho, Walters, 1966; Scholtissek, Rott, 1969a; Skehel, Burke, 1969; Ruck ir kt., 1969; Mahy, Bromley, 1970; Compans, Caliguiri , 1973). Didžioji dalis fermento aktyvumo buvo nustatyta užkrėstų ląstelių mikrosominėje frakcijoje. In vitro sistemoje šį aktyvumą pašalina RNazė, bet ne DNRazė. Tai reiškia, kad vidinis šablonas yra RNR. Reakcijai reikalingas visų keturių nukleozidų trifosfatų buvimas ir ji yra jautri aktinui-icinui D. Dauguma in vitro reakcijos produkcijos turi mažą santykinę molekulinę masę. Horisberger ir Guskey (1973) duomenys rodo, kad citoplazmoje yra du skirtingi fermentų aktyvumai: vienas priklauso nuo Mg++ ir jį slopina santykinai didelė druskų koncentracija, kita priklauso nuo Mn++ ir yra atsparesnė druskai. Pastarojo fermento aktyvumas aptinkamas ir viruso dalelės viduje (žr. 5 skyrių).
Gauti prieštaringi rezultatai dėl citoplazminio fermento produkto in vitro sistemoje. Ruck ■ ir kt. (1969) pranešė, kad jų rankose šis fermentas sintezuoja bent „kai kurias viriono tipo RNR (14–19S). Tokios išvados autoriai priėjo nustatydami produkto bazinę sudėtį in vitro sistemoje po mikrosomų inkubacijos. frakcija su visais keturiais žymėtais žinomo specifinio radioaktyvumo nukleozidų trifosfatais. Tačiau artimiausio tyrimo duomenys
adenilo rūgšties kaimynams, gautiems atliekant tą patį darbą naudojant [(a-32P]ATP), atitinka artimiausio kaimyno analizės duomenis, gautus Scholtisseko (1969), todėl buvo padaryta išvada, kad produktas in vitro sistemoje turi tokią struktūrą. Mahy ir Bromley (1970) savo pirminiame leidinyje taip pat teigė, kad tam tikra produkto dalis in vitro sistemoje, kurią gamina citoplazminis fermentas, turi būti „vRNR“. ir specifinė hibridizacija patvirtino citoplazminio fermento susidarymą beveik vien tik iš cRNR, kaip pirmą kartą parodė Scholtissekas (1969). Caliguiri ir Compans (1973) taip pat išskyrė RNR polimerazę iš gripo virusu užkrėstų ląstelių citoplazmos, kuri sintezavo RNR. in vitro sistema, kurioje mažiau nei 90 % jų turi hsRNR komplementarią bazinę seką. Hastie ir Mahy (1973) „nustatė, kad didelė produkto dalis in vitro sistemoje, kurią sintezuoja branduolinis fermentas, dalyvaujant aktinomicinui D, buvo negali pibridizuotis su nepažymėta vRNR.Kol kas neaišku, koks RNR tipas nėra pajėgus tokiai hibridizacijai. Labai mažai tokiomis sąlygomis susintetintos RNR hibridizuojasi su nepažymėta aRNR (Scholtisek, neskelbti duomenys).
Pažymėto GTP įtraukimo į viruso RNR kinetika gali būti aiškinama kaip rodanti, kad RNR sintezė in vitro sistemoje neatnaujinama. Jei neapdorotas fermentinis preparatas inkubuojamas esant mažoms druskos koncentracijoms, beveik visa naujai susintetinta RNR iš pradžių yra vienagrandė. Tačiau po ekstrahavimo fenoliu „didelė dalis RNR tampa atspari RNRazei. Fenolis paverčia tarpinę replikacijos struktūrą, susidedančią iš vienos grandinės šablono ir naujai susintetintos cRNR, kurią replikacijos vietoje laiko kartu polimerazės molekulė. iš dalies dvigrandė struktūra (Feix ir kt., 1967; Oberg, Philipson, 1971). Šie duomenys apie gripo viruso fermento produktą in vitro sistemoje gali būti interpretuojami taip, kad polimerazė ne tik inicijuoja ir tęsia polimerizaciją, bet ir atskiria naujai susintetintą grandinę nuo savo šablono. Priešingu atveju susidaro dvigrandė RNR struktūra, kuri neturi jokių biologinių funkcijų (Paffenholz ir Scholtissek, 1973) Jei inkubuojama esant didelėms druskų koncentracijoms arba su išgrynintu fermentu, didelė produkto dalis jau yra dvigrandė RNR. prieš ekstrahuojant fenoliu (Schwartz, Scholtissek, 1973).
Ši gripo viruso RNR polimerazės savybė sintetinti išskirtinai cfRNR in vitro sistemoje buvo išnaudota.
Ji raginama nustatyti skirtingų gripo viruso padermių genetinį ryšį, nustatant homologiją tarp jų bazinėje sekoje (Scholtissek, Rott, 1969b; Hobson, Scholtissek, 1970; Anschutz ir kt., 1972).
IV. VIRUSINIŲ BALTYMŲ SINTEZĖ
A. IN VITRO VERTIMAS
Problema, kokio tipo RNR – vir joninė ar komplementari – yra informatyvi viruso baltymų sintezei, dar neišspręsta. Gauti prieštaringi rezultatai dėl virusui specifinės RNR, susijusios su polisomomis, tipo. Nayak (1970) atrado sacharozės gradientas polisominėje srityje, daugiausia vRNR, o Pons (1972) iš polisos išskyrė tik vcRNR. Pastarąjį patvirtino stebėjimas, kad pridėjus aktinomicino D, kuris pirmiausia veikia vcRNR sintezę (žr. III skyrių, B, 1), praėjus 2 valandoms po užsikrėtimo, cfRNR neaptikta užkrėstų ląstelių polisomose (Pons, 1973).
Naudodami baltymų sintezės sistemą iš E. coli ir gripo viruso vRNR kaip šabloną, Siegert ir kt. (1973) atrado viruso NP baltymo susidarymą in vitro. Šis pažymėtas NP baltymas buvo apibūdintas gelio nusodinimu naudojant Ouchterlony testą. Priešingai , Kingsbury ir Webster (1973) nepastebėjo jokios viruso baltymų sintezės su vRNR naudojant baltymų sintezės sistemą, gautą iš triušio retikulocitų. Tačiau toje pačioje sistemoje jie aptiko viruso M baltymo sintezę (om. 2 skyrius) RNR. iš infekuotų ląstelių išskirtas šablonas.Todėl šiuo metu neįmanoma atsakyti į klausimą, ar tik viriopinis, ar tik komplementarus, ar kai kurie vieno tipo RNR fragmentai ir kai kurie kito tipo RNR fragmentai naudojami kaip šablonai baltymų sintezei. Kol kas gripo virusams sunku taikyti „neigiamos“ arba „teigiamos“ viruso grandinės apibrėžimą, kaip pasiūlė Baltimore (1971).
B. VIRUSINIŲ BALTYMŲ SINTEZĖ IN VIVO
Viruso „baltymų“ sintezės tyrimą palengvina tai, kad užkrėstoje ląstelėje ląstelių polipeptidų sintezę pakeičia virusui būdinga sintezė. Vištienos embriono fibroblastų ląstelėse, užkrėstose ŽPV (Joss ir kt., 1969; Skehel, 1972; Klenk, Rott, 1973), ir BHK 2IF ląstelėse, užkrėstose WSN gripo viruso paderme (Lasarowitz ir kt., 1971), Beveik 4 valandas po užsikrėtimo susintetina
tik virusiniai baltymai (31). Kiek anksčiau mokslininkai stebėjo trijų ar keturių polipeptidų sintezę užsikrėtusiose erkėse (Taylor ir kt., 1969; Joss ir kt., 1969; Holland, Kiehn, 1970; White ir kt., 1970). Vėliau buvo atrasti kiti polipeptidai (Lazorowitz ir kt., 1971; Skehel, 1972; Klenk ir kt., 1972b; Krug, Etkind, 1973). Apskritai užkrėstose ląstelėse buvo aptikti visi struktūriniai β baltymai: vienas arba du P baltymai, nukleokapoidinis subvienetas NP, membraninis baltymas M, hemagliutinio glikoproteinas neskaldytose (HA) ir suskaidytose (HA1 ir HA2) formose ir NA subvienetas. .
Be viriono baltymų, buvo aprašytas vienas ar du nestruktūriniai baltymai (NS).
Yra pastebimų skirtumų<в уровнях синтеза отдельных вирусных полипептидов. NP- и NS-полипептиды обычно первыми обнаруживаются в зараженных «летках. Skehel (1973) предположил, что полипептиды Р2, NP и NS, которые первыми обнаруживаются в «клетках, зараженных ВЧП, являются
RNR fragmentų produktai, susidarę per selektyvią trijų viruso genomo fragmentų transkripciją viriono polimeraze. Kai ląstelės buvo užkrėstos esant cikloheksimidui ir pašalinus antibiotiką buvo pridėta pulso žyma, buvo aptikti tik šie trys polipeptidai. Remiantis tuo, buvo daroma prielaida, kad šių komponentų RNR molekulės susidarė su įvestos viriono lolimerazės pagalba pirminės transkripcijos metu. Nuo 4 iki 6 valandos po vištienos fibroblastų užsikrėtimo ŽPV M-baltymų sintezės lygis didėja, o NS-lolileptido sintezė mažėja (Skehel, 1972, 1973). Taigi iolipeptidų sintezės lygiai gali būti kontroliuojami individualiai ir gali skirtis augimo ciklo metu.
Išskyrus HA polipeptido skilimą į HA1 ir HA2, nėra jokių įrodymų, kad virusui specifiniai gripo viruso polipeptidai gaunami dėl didelių pirmtakų skilimo (Taylor ir kt., 1969; Lazarowitz ir kt., 1971, Skehel). , 1972; Klenk, Rott, 1973).
Neseniai buvo gauta naujos informacijos apie viruso komponentų lokalizaciją užkrėstose ląstelėse, naudojant autoradiografiją (Becht, 1971) arba ląstelių frakcionavimo ir gelio elektroforezės metodus (Taylor ir kt., 1969, 1970). Remiantis šiais tyrimais, visų viruso baltymų sintezė vyksta citoplazmoje. Ankstesni nukleotidų antigeno lokalizacijos imunofluorescencijos būdu tyrimai buvo interpretuojami kaip rodantys, kad branduolyje vyksta sintezė, o vėliau antigenas išsiskiria į citoplazmą (Liu, 1955; Breitenfeld ir Schafer, 1957; Holtermann ir kt., 1960). Tačiau akivaizdu, kad imunofluorescencija lemia antigeno kaupimąsi, o ne jo sintezę (žr. IV, B, 2 skyrių).
1. RNR polimerazė
Nuo RNR priklausomos RNR polimerazės virusui būdingas aktyvumas gali būti aptiktas ląstelėse, užkrėstose gripo virusu, praėjus 13–3 valandoms po užsikrėtimo, priklausomai nuo naudojamos ląstelių sistemos (Scholtisek ir Rott, 1969a; Skehel ir Burke, 1969; Ruck ir kt. al., 1969; Mahy, Bromley, 1970). Tai pirmas aptinkamas virusui būdingas aktyvumas po užsikrėtimo. Didžioji dalis viruso lolimerazės aktyvumo aptinkama mikrosomų frakcijoje; dalis šios veiklos lieka branduoliuose ir negali būti iš ten pašalinta net intensyviai plaunant. Nėra esminių skirtumų tarp branduolinių ir mikrosominių fermentų pasireiškimo kinetikos ar būtinų kofaktorių (Scholtisek ir Rott, 1969a; Mahy ir kt., 1975).
Toliau frakcionuojant citoplazmą laipsniškame sacharozės gradiente, naudojant Caliguiri ir Tamm (1970) metodą, polimerazės aktyvumas aptinkamas šiurkščiose membranose (Compans ir Caliguiri, 1973; Klenk ir kt., 1974a).
Kadangi viruso polimerazės aktyvumas buvo aptiktas išgrynintose viruso dalelėse (žr. 5 skyrių), kyla klausimas, su kuriuo iš viruso baltymų jis gali būti susijęs.Polimerazė, išskirta iš gripo virusu užkrėstų ląstelių, buvo išgryninta maždaug 200 kartų. Vienintelis virusui būdingas produktas, susijęs su polimerazės aktyvumu, buvo RNP antigenas (NP baltymas ir virusinė vRNR, nustatyta komplemento fiksavimo metodu). Visi bandymai pašalinti RNR iš šio komplekso lėmė visišką fermento aktyvumo praradimą (Schwarz ir Scholtissek, 1973). P baltymas buvo pasiūlytas kaip kandidatas į virusinės polimerazės vaidmenį (Kilbourne ir kt., 1972). Kai fermentinis kompleksas, pažymėtas in vivo aminorūgštimis, buvo išskirtas iš gripo virusu užkrėstų ląstelių ir išgrynintas maždaug 35 kartus, elektroforezės analizė iš pradžių atskleidė tik HP-beloa šiame komplekse.< (Compans, Caliguiri, 1973). Впоследствии, однако, при других условиях введения;метки удалось обнаружить и Р-белок (Caliguiri, Compans, 1974). С другой стороны, Klenk и соавт. (1974) обнаружили Р-белок в цитоплазматическом золе, "который не обладает полимеразной активностью (Scholtissek, Rott, 1969a; Skehel, Burke, 1969). Эти наблюдения могут означать, что Р-белок осуществляет свою (Предполагаемую активность ферментов только при связывании с РНП-антигеном.
Mažai tikėtina, kad pats RNP antigenas turi polimerazės aktyvumą, nes hiperimuninis serumas prieš RNP antigeną neslopina polimerazės aktyvumo, o sveikstantis serumas, kuriame gali būti antikūnų prieš polimerazę, veikia (Scholtissek ir kt., 1971). Šis sveikstantis serumas (gautas iš A gripo virusais užsikrėtusių gyvūnų) slopino visų tirtų A gripo viruso padermių polimerazės aktyvumą, bet neslopino B gripo viruso polimerazės aktyvumo. Visi šie stebėjimai atitinka idėją, kad RNP- antigenas (BPHK + NP = baltymas), gali būti naudojamas kaip cRNR sintezės šablonas.
2. Nukleokapsidės baltymas
NP baltymas jungiasi prie viruso RNR, sudarydamas RNP antigeną.Tai pasakytina apie NP baltymą, išskirtą ne tik iš viriono, bet ir iš užkrėstos ląstelės (Schafer, 1957). „Pirmą kartą jį galima aptikti serologinėmis priemonėmis, kai
maždaug 3 valandos po užsikrėtimo, valanda iki hemagliutinino atsiradimo (Breitenfeld, Schafer, 1957). Po šio laiko RNP antigeno titras reikšmingai nepadidėja. Tai gali įvykti dėl pusiausvyros tarp naujos sintezės ir įtraukimo į subrendusias daleles. Ženklinant NP baltymą galima „aptikti užkrėstose ląstelėse per 2 valandas po užsikrėtimo (Scholtissek ir Rott, 1961; Krug, 1972).
Fluorescuojančių antikūnų pagalba RNP antigenas pirmiausia aptinkamas branduoliuose. Vėliau jis atsiranda citoplazmoje (Breitenfeld ir Schafer, 1957). Tam tikromis sąlygomis, pavyzdžiui, persileidus infekcijai (Franklin, Brietenfeld, 1959), esant p-fluorfenilalaninui (Zimmermann, Schafer, 1960), arba fon Magnuso fenomeno sąlygomis (Rott, Scholtissek, 1963), RNP antigenas. lieka branduoliuose.
Ankstyvas RNP antigeno kaupimasis užkrėstų ląstelių branduoliuose nereiškia, kad NP baltymas taip pat sintetinamas branduolių viduje. Autoradiografiniai tyrimai, taip pat ląstelių frakcionavimo metodai rodo šio ir kito baltymo, kuriame gausu arginino, citoplazminę sintezę ir greitą jų pernešimą iš citoplazmos į branduolius (Taylor ir kt., 1969, 1970; Becht, 1971).
Užkrėstų ląstelių ekstraktuose tam tikroje RNP antigeno dalyje yra vRNR (Pons, 1971; Krug, 1972; Krug, Etkind, 1973), nors viruso dalelėse randama tik vieno tipo RNR (tai atsiranda dėl to, kad nėra vRNR savaiminė hibridizacija) (Scholtissek, Rott, 1971; Pons, 1971). Neįmanoma nuspręsti, ar RNP antigenas, turintis cfRNR, turi specifinį vaidmenį viruso dauginimosi procese, ar tai tik artefaktas, atsirandantis ląstelių frakcionavimo procese. Buvo parodyta, kad abi RNR grandinės vienodai gerai jungiasi su NP baltymu in vitro (Scholtissek ir Becht, 1971). Taigi, jei yra laisvo NP baltymo ir laisvos cRNR, homogenizacijos proceso metu iš karto susidaro atitinkamas RNP antigenas. Viriono RNR gali būti išstumta iš RNP antigeno polivino "Ilsulfatu" M (Pons ir kt., 1969). Todėl galima išbandyti, ar ląstelių homogenatuose galima pakeisti skirtingas viruso RNR RNP antigene. Remdamasis virusinės RNR, pažymėtos įvairiais laikotarpiais 32P ir išskirtos iš citoplazminio RNP antigeno, bazinės sudėties pokyčių, Krug (1972) daro išvadą, kad dalis cfRNR, prieš įtraukiant ją į RNP antigeną, egzistuoja laisva forma. iš NP- voverė. 32P įterpimas į gyvūnų pūslelių RNR įvyksta su reikšminga vėlavimo faze dėl gana lėto žymėto fosforo įterpimo į nukleozidų trifosfatų x padėtį (Scholtissek, 1965). Kol bus atlikti atitinkami koregavimai skaičiuojant sudėties pokyčius.
nebuvo padaryta jokio pagrindo, Krug (1972) duomenys turėtų būti interpretuojami atsargiai.
Krug (1972) atlikta „RNP antigeno atsiradimo branduoliuose ir citoplazmoje“ kinetinė analizė rodo, kad branduoliuose besikaupiantis RNP antigenas nėra RNP antigeno, esančio citoplazmoje, pirmtakas.
3. Nestruktūriniai baltymai
Užkrėstoms ląstelėms buvo aprašyti keli nestruktūriniai virusui būdingi baltymai, kurių funkcija nežinoma. Vienas iš jų, kurio santykinė molekulinė masė yra 25 000, kuri kaupiasi dideliais kiekiais, buvo pavadinta NS (Lazarowitz ir kt., 1971). Poliakrilamido gelyje jo migracijos greitis yra artimas M baltymo mobilumui. abu baltymai, atrodo, nepriklauso vienas nuo kito, kaip matyti iš jų peptidų žemėlapių skirtumų. Branduoliuose randama daug NS baltymų (Lazarowitz ir kt., 1971; Krug, Etkind, 1973). Ši informacija atitinka ankstesnių Dim-mock (1969) imunofluorescencinių tyrimų duomenis, kurie pastebėjo „ryškų branduolių dažymąsi antiserumu, būdingu nestruktūriniams viruso antigenams, ir šis dažymas tikriausiai atspindėjo NS baltymo buvimą. būti pagrindinis virusui specifinis baltymas laisvų ir su membrana surištų ribosomų frakcijose, išskirtose iš užkrėstų ląstelių (Pons, 1972; Compans, 1973; Klenk ir kt., 1974a). Atrodo, kad NS ryšys su ribosomomis priklauso nuo toninės jėgos (Krug ir Etkind, 1973). Mažo joninio stiprumo buferiuose ŠIS nolipaptidas buvo adsorbuotas ant abiejų ribosomų subvienetų, o pridėjus druskos iš jų pašalintas.
Neseniai atliktas tyrimas (Gregoriades, 1973) sukėlė tam tikrų abejonių dėl NS identifikavimo kaip nestruktūrinio polipeptido, besiskiriančio nuo viriono polipeptido M. M-polipeptidą iš viriono buvo įmanoma išgauti rūgštiniu chloroformmetanoliu ir baltymu. su identišku elektroforezės judrumu taip pat gali būti išgaunamos iš ištisų užkrėstų ląstelių, -branduolių ar polisomų.. Analizuojant M baltymo, taip pat su branduoliu ir ribosomomis susijusius baltymus, triptinio apdorojimo produktus, nustatyta daug atitikmenų, o tai rodo, kad M ir NS baltymai yra identiški, tačiau norint pateikti įtikinamą šių rezultatų paaiškinimą, reikia papildomos informacijos.
Be NS, gali būti ir kitų nestruktūrinių virusui būdingų komponentų, nors nė vieno iš jų nėra. nebuvo pakankamai apibūdintas. Naudojant antiserumą, nukreiptą prieš nestruktūrinius viruso antigenus,
Dimmock ir Watson (1969) nusodino radioaktyviai pažymėtus polipeptidus iš užkrėstų ląstelių. Elektroforetinė analizė poliakrilamido gelyje parodė, kad yra keletas nestruktūrinių polipeptidų, kurių pagrindinis komponentas atitinka NS. Vienas iš likusių nestruktūrinių komponentų migruoja greičiau ir gali atitikti santykinės molekulinės masės komponentą nuo 10 000 iki 15 000, aprašytą Skehel (1972) ir Krug ir Etkind (1973).
4. Membranos M baltymas
Užkrėstose ląstelėse santykinai nedideliais kiekiais randamas M baltymas, kuris iškloja vidinį apvalkalo lipidinio dvisluoksnio paviršių ir kuriame gausu viriono. Tai rodo ne tik M baltymo sintezės valdymą, bet ir galimybę, kad tai sintezė yra viruso dauginimosi greitį ribojanti stadija (Lazarowitz ir kt., 1971) Šią koncepciją patvirtina duomenys, kad esant 29 °C temperatūrai, kurioje viruso gamyba yra slopinama, M baltymas yra vienintelis virusui būdingas baltymas. baltymas, kurio negalima aptikti užkrėstose ląstelėse (Klenk, Rott, 1973).
M baltymas (gali būti randamas ant lygiųjų ir plazminių infekuotų ląstelių membranų (Lazarowitz ir kt., 1971; Cornpans, 1973a; Klenk ir kt., 1974a). Šie duomenys rodo šio baltymo afinitetą membranoms.
5. Hemagliutininas
Hemagliutininas sintetinamas kaip didelis glikoproteinas – HA pirmtakas, kuris vėliau suskaidomas į du mažesnius glikoproteinus: HAi ir HA2 “(Lazarowitz ir kt., 1971). Skilimas, kurį gali slopinti proteazės inhibitoriai (Klenk, Rott, 1973). ). serumo terpėje (Lazarowitz ir kt., 1971, 1973a, b; Klenk, Rott, 1973; Stanley ir kt., 1973). Taigi WSN, auginamas viščiukų embrionų fibroblastų kultūroje, turi tik suskaldytus hemagliutnino glish baltymus, skilimo praktiškai nėra, jei WSN virionai auginami MDBK ląstelėse be serumo. Tačiau esant serumui, WSN hemagliutininas taip pat suskaidomas.
sistema vyksta plazminėje membranoje (Lazaro-witz ir kt., 1973a). VChP sistemoje tokio padalijimo mechanizmas, matyt, skiriasi. Skilimas „vyksta tarpląstelinėse membranose, o plazminogenas šiuo atveju nėra būtinas (Shchepk ir kt., 1974a). Skilimo laipsnis smarkiai sumažėja esant 25 °C (Klenk ir Rott, 1973).
HA skilimas nėra būtinas hemagliutinuojančiam aktyvumui ar virionų surinkimui (La-zarowitz ir kt., 1973a; Stanley ir kt., 1973), tačiau naujausi tyrimai parodė, kad jis reikalingas užkrečiamumui užtikrinti (Klenk ir kt., 1975b). Šie duomenys atitinka hipotezę, kad, be savo vaidmens adsorbcijoje, HA* atlieka ir kitą funkciją infekcijos procese ir šiai funkcijai būtinas skilimas. , ir kad dalelės, kuriose yra neskaldytos HA, yra mažai užkrečiamos, rodo, kad gripo viruso infekcijos šeimininko diapazonas ir plitimas priklauso nuo šeimininko ląstelės proteazės, kaip aktyvuojančio fermento, buvimo.
Atliekant eksperimentus, skirtus frakcionuoti vi
Rus gripo, buvo nustatyta, kad HA glikoproteinai yra visada
yra susiję su membranomis (Compans, 1973a; Klenk ir kt.,.
1974a). Šių baltymų tarpląstelinė lokalizacija ir jų momentas
racija nuo šiurkščių membranų iki lygių endoplazminių membranų
dangaus tinklas ir į plazmines membranas bus de
yra išsamiai aprašyti VII skyriaus B dalyje. .,
6. Neuraminidazė
Buvo atrastas virusinis NA* kaip aktyvus fermentas
3 valandas po užsikrėtimo chorioninėje alantoidinėje membranoje
nakh, o ekstrapoliuojant nustatyta, kad jo sin
disertacija atsiranda praėjus 1-2 valandoms po užsikrėtimo (Noll ir kt.,
1961). NA* tarpląstelinė lokalizacija buvo tiriama naudojant
tada ląstelių frakcijos, ir nustatė, kad ji, matyt
mu, yra panašus į HA* lokalizaciją (Compans, 1973a; Klenk ir kt.,
1974a). NA* buvo rasta kartu su membranomis,
gaunamas iš lygaus endoplazminio tinklo,
nustatant jį pagal biologinį aktyvumą ir analizuojant
zu poliazhrilamido gelyje. Fermentų aktyvumas buvo didelis
dena taip pat frakcijose, kuriose yra šiurkščių membranų
mus. Šie duomenys atitinka duomenis, gautus iš
imunofluorescencija (Maeno, Kilbourne, 1970). Po 4 valandų
po užsikrėtimo citoplazmoje galima aptikti neuraminidazę
plazma; vėliau ji, atrodo, susikoncentruoja į peri
ląstelių ferija.
V. ANGLIAVANDENIŲ SINTEZĖ
Angliavandeniai dalyvauja formuojantis gripo viruso apvalkalo glikoproteinams ir glikolidams (Klenk ir kt., 1972a). Miksovirusų glikolipidai (kilę iš ląstelės-šeimininkės plazmos membranų (Klenk, Choppin, 1970), tačiau nenustatyta, kurie daugiausia yra įtraukti į virioną: jau esami ar naujai susintetinti glikolipidai.
Naudojant radioaktyvius pirmtakus, tokius kaip gliukozaminas, manozė, galaktozė ir fukozė, kurie yra specialiai įtraukti į virusinius gliukopeltidus, nustatyta, kad šių glikopeptidų angliavandenių šoninės grandinės yra sintezuojamos infekcijos metu (Haslam ir kt., 1970; Cornpans ir kt., 1970a; Schwarz ir Klenk, 1974). Ląstelių frakcionavimo eksperimentai suteikė papildomos informacijos apie virusinių glikoproteinų glikozilinimo vietas Gliukozaminas yra susijęs su HA polipeptidu tiek lygioje, tiek šiurkščioje citoplazmos membranos frakcijose, tačiau fukozė yra susijusi su HA lygiose, bet ne grubiose membranose (Compans, 1973b). Baltymų sintezės slopinimas puromicinu beveik iš karto sustabdo gliukozamino įsisavinimą, o fukozė ir toliau įsijungia apie 10-15 minučių (Stanley ir kt., 1973). Galiausiai FPV glikoproteinas yra HA ir skilimo pirmtakas. HAj gaminiai<и НА2 содержат, по-видимому, полный состав маннозы « глюкозамина, тогда как содержание фукозы и галактозы значительно выше в продуктах расщепления (Klenk et al., 1975a; Schwarz, Klenk, 1974). Эта наблюдения предполагают, что биосинтез углеводных боковых целей гликопротеинов НА осуществляется по стадиям с различными остатками Сахаров, добавляемыми в разных участках клетки. Глюкозамин и манноза (присоединяются, по-видимому, к полипептидам НА на шероховатых мембранах вскоре после или даже в процессе синтеза поляпептида, в то время как фукоза, вероятно, прикрепляется позже с помощью трансфераз, присутствующих в гладких мембранах.
Šios glikoziltransferazės tikriausiai yra ląstelių fermentai. Todėl angliavandenių (dalį glikoproteinų, matyt, lemia ląstelė-šeimininkė. Tačiau yra įrodymų, kad be šių šeimininko ląstelės fermentų, angliavandenių šoninių grandinių formavime reikšmingą vaidmenį atlieka ir virusinė NA*. nustatyta, kad miceovirusų lukštų paviršiuje trūksta neuramino rūgšties (Klenk, Choppin, 1970b; Klenk ir kt., 1970), o virusų apvalkaluose, kuriuose šio fermento nėra, toks angliavandenis yra įprastas komponentas (Klenk, Choppin, 1971). McSharry, Wagner, 1971; Renkonen ir kt., 1971) Šie duomenys rodo, kad
Neuramino rūgšties poveikis yra esminė miksovirusų savybė. Neseniai buvo įrodyta, kad NA* yra atsakinga už neuramino rūgšties pašalinimą iš gripo viruso apvalkalo, taip užkertant kelią receptorių susidarymui viruso apvalkale, dėl kurio kitu atveju susidarytų dideli viruso dalelių agregatai (Palese ir kt., 1974). Šie duomenys patvirtina koncepciją, kad NA*, kaip pagrindinio paviršiaus glikoproteino, angliavandenių dalis yra (ląstelių transeferazių ir viruso NA*) kombinuoto veikimo produktas. Dėl savo veikimo virusas gali įnešti virusą. specifinė modifikacija į (Iš pradžių, šeimininkui būdinga, sudėtinga angliavandenių modifikacijos struktūra, kuri, pasak -matyt, būtina viruso biologiniam aktyvumui.
D-gliukozaminas ir 2-deoksi-O-gliukozė slopina biologiškai aktyvaus HA*, NA* ir infekcinio viruso susidarymą (Kilbourne, 1959; Kaluza ir kt., 1972). Biocheminiai tyrimai atskleidė, kad šie cukrūs konkuruoja su virusinių glikoproteinų biosinteze (Ghandi ir kt., 1972; Klenk ir kt., 1972b). Esant šiems inhibitoriams glikoproteino NA dydis mažėja.Sumažėjimo laipsnis priklauso nuo dozės.Taigi, didėjant cukraus koncentracijai, glikoproteinas NA, kurio santykinė molekulinė masė yra 76 000, palaipsniui virsta junginiu su 64 000 molekulinė masė, kuri buvo pavadinta HA0 (Klenk ir kt., 1972b; Schwarz ir Klenk, 1974). Molekulinės masės pokytis yra lygiagretus angliavandenių kiekio sumažėjimui, o HA0 baltyme angliavandenių beveik nėra (Schwarz). ir Klenk, 1974). Šie rezultatai rodo, kad HA0 yra nepilnai glikozilinta arba "eglikozilinta HA glikoproteino polipeptidinė grandinė ir kad slopinamasis D-gliukozės amino a ir 2-deoksi-O-gliukozės poveikis atsiranda dėl glikozilinimo pažeidimo. HA0 polipeptidas yra susijęs su membranomis, kaip ir normalus HA. Jis taip pat migruoja iš šiurkščiojo į lygųjį tinklelį, kur suskaidomas į polipeptidus HA01 ir HA02. Todėl angliavandeniai tikriausiai nėra būtini šio polipeptido afinitetui membranai. Tačiau hemagliutinuojančio aktyvumo nebuvimas užkrėstose ląstelėse rodo, kad neglikozilintas baltymas negali prisijungti prie receptorių.
VI. LIPIDŲ SINTEZĖ
Kaip ir visi apvalkalą turintys virusai, gripo virusas lipidus įgyja perdirbdamas šeimininko ląstelės lipidus. Šią poziciją patvirtina šie pastebėjimai:
Denia. Nustatyta, kad gripo viruso lipidų sudėtis yra panaši į šeimininko ląstelės lipidų sudėtį (Ambruster ir Beiss, 1958; Frommhagen ir kt., 1959). Ląstelių-šeimininkų lipidai, radioaktyviai pažymėti prieš infekciją, yra įtraukiami į viruso daleles (Wecker, 1957). Kai virusas auginamas įvairiose šeimininko ląstelėse, aptinkamos viruso lipidų modifikacijos (Kates ir kt., 1961, 1962). Apskritai, virusų lipidai (kurie iškyla iš ląstelės paviršiaus, glaudžiai atspindi ląstelės šeimininkės plazminės membranos lipidų sudėtį (Klenk, Choppin, 1969; 1970a, b; Renko-nen ir kt., 1971). de novo sintezės fosfolilidų lygis viščiukų embriono fibroblastų ląstelėse išliko nepakitęs 7 valandas po užsikrėtimo gripo virusu, po to buvo slopinama visa lipidų sintezė (Blough ir kt., 1973). Šis slopinimas tikriausiai nėra pagrindinis poveikis, bet gali būti antrinis, palyginti su RNR arba baltymų sintezės slopinimu arba „kitu biologiniu poveikiu.
Taigi, remiantis iki šiol gautais rezultatais, galima daryti prielaidą, kad virusinių lipidų sintezė vyksta normaliais ląstelių lipidų biosintezės procesais, o viruso apvalkalas susidaro įsijungiant lipidams iš ląstelės šeimininkės plazminės membranos.
VII. SURINKIMAS (taip pat žr. 2 skyrių)
A. NUKLEOKAPSIDŲ FORMAVIMAS
Kaip jau minėta, labiausiai tikėtina, kad nukleokapsidės baltymas sintetinamas citoplazmoje. Matyt, jis ten yra trumpą laiką laisvoje formoje, o vėliau asocijuojasi su virusine RNR, sudarydamas nukleokapsides (Klenk ir kt., 1974; Compans ir Caliguiri, 1973). Kadangi NP baltymas greitai įtraukiamas į yaucleokapsids, RNR galima pasirinkti iš reformuoto telkinio (Krug, 1972). Dėl mažo gripo viruso nukleokapsidų dydžio jų negalima tiksliai identifikuoti užkrėstose ląstelėse naudojant elektroninę mikroskopiją. Citoplazmoje pastebėtos gijų arba skaidulų sankaupos, kurių skersmuo yra apie 5 nm, gali būti viruso ribonukleoproteinai (Apostolov ir kt., 1970; Compans ir kt., 1970b).
Turimi duomenys rodo, kad gripo viruso virionų RNR genomas susideda iš 5-7 fragmentų (žr. 6 skyrių).
Todėl bet kuriai infekcinei dalelei reikia bent vienos kiekvieno fragmento kopijos. Hirstas (1962) iki
Teigiama, kad nukleokapsidės iš tarpląstelinio telkinio gali būti įtrauktos į (virionai atsitiktinai. Infekcinių virionų dalis E populiacijoje gali būti padidinta įtraukiant papildomus RNR fragmentus į vidutinį virioną (Compans ir kt., 1970). Pavyzdžiui, jei penki būtini infekciniams skirtingiems RNR fragmentams, kiekviename viruse iš viso yra 7 fragmentai, atsitiktinai įtraukti į virusą, tada maždaug 22% virionų turėtų būti infekciniai. Įrodymai, kad RNR fragmentai buvo atsitiktinai įtraukti, buvo sustiprinti naujausiais Hirsto stebėjimais. 1973), kad viruso populiacijoje vyksta rekombinacija tarp dalelių, kurios nesudaro plokštelių. Tokių dalelių gebėjimą dalyvauti rekombinacijoje galima paaiškinti tuo, kad dalelėse nėra vieno ar daugiau fragmentų, o trūkstami fragmentai skiriasi nuo vienos dalelės. į kitą, kad tinkamos sugedusio viruso dalelės galėtų sudaryti rekombinantus.
B. VIRUSŲ SUJUNGIMO PROCESAS
Kaip ir dauguma apvalkalo virusų, gripo virusas kaupiasi ant iš anksto suformuotų ląstelių membranų; surinkimas vyksta pumpurais iš plazminės membranos. Pirmą kartą viruso išsiskyrimą iš ląstelės naudojant procesą, kuriame nėra lizės, pateikė Murphy ir Bang (1952), atlikdami ankstyvus elektronų mikroskopinius tyrimus su gripo virusu užkrėstomis ląstelėmis.Gijinės ir ■ sferinės struktūros. Formuojantis infekciniam virusui ląstelių viduje nebuvo matomos viruso dalelės, todėl buvo aišku, kad viruso dalelės formuojasi ląstelės paviršiuje.Naudodami feritinu pažymėtus antikūnus, Morgan ir kt. (1961) pastebėjo, kad ląstelės paviršiuje yra viruso. antigenas tose vietose, kur susiformuoja virusas.Vlesni elektronmikroskopiniai tyrimai parode, kad pumpuruojancio viruso pavirius turi ta pati membrana kaip ir ląstelė-šeimininkė su projekcijų sluoksniu, atitinkančiu viruso „spygliukus“ išoriniame paviršiuje.Vidiniame paviršiuje Viruso membranos paviršiuje ląstelės paviršiuje nėra papildomo elektronų tankio sluoksnio, kuris tikriausiai susideda iš M-olipeptidų (Bachi ir kt., 1969; Compans, Dimmock, 1969; Apostolov ir kt., 1970).
Elektroninio mikroskopo tyrimai davė pagrindo ■ pasiūlyti, kokia tvarka virusiniai komponentai
asocijuojasi su ląstelės membrana (Bachi ir kt., 1961; Compans ir Dimmock, 1969; Compans ir kt., 1970b).
Viruso apvalkalo baltymai atsiranda pirmiausia, įtraukiami į kai kurias membranos sritis, kurios turėtų turėti normalią morfologiją; tačiau pastebėta specifinė eritrocitų adsorbcija šiose membranos vietose rodo, kad čia yra HA baltymo. Tada, matyt, M baltymas asocijuojasi su tokių membranos sričių vidiniu paviršiumi, sudarydamas elektronų tankų sluoksnį.Toliau šiose srityse ribonukleoproteinas specifiškai prisijungia prie membranos ir membraną lenkiant ir išsikišus vyksta pumpurų atsiradimo procesas. Poliakrilamido gelio elektroforezės duomenys taip pat patvirtina mintį, kad apvalkalo baltymai su plazmos membrana susijungia greičiau nei RNP (Lazarowitz ir kt., 1971). viruso apvalkalas, nes tokių polipeptidų nerandama išgrynintuose virionuose. Kaip jau minėta, neuramino rūgšties likučių nėra pumpuruojančių gripo viruso dalelių apvalkale, bet yra gretimose ląstelės membranos vietose (Klenk ir kt., 1970). .
Šie duomenys rodo dramatišką cheminės sudėties perėjimą tarp augančios viruso dalelės apvalkalo ir gretimos ląstelės membranos.
Tačiau, kita vertus, svarbus pumpuravimo proceso bruožas yra tas, kad viruso apvalkalas yra ištisinis su ląstelės-šeimininkės plazmos membrana ir yra morfologiškai panašus į ją (Compans ir Dimmock, 1969). Kaip minėta, šiose membranose esantys lipidai yra labai panašūs į šeimininko ląstelės membranos lipidus. Šie stebėjimai rodo, kad lipidai nepažeistoje plazmos membranoje lengvai keičiasi lipidais augančiose viruso dalelėse radialinės difuzijos būdu.
Vadinasi, augančio viriono apvalkalas susidaro iš nedidelio ląstelės membranos regiono, modifikuoto įtraukiant viriono apvalkalo baltymus. Ši koncepcija, žinoma, nereiškia, kad plazmos membranoje reikia sintezuoti visus membranos komponentus.
Iš tiesų, jau seniai žinoma, kad membranos sudedamosios dalys turi migruoti dideliais atstumais iš vienos ląstelės dalies į kitą, kad patektų iš jų biosintezės vietos į membranos surinkimo vietą. Breitenield ir Schafer (1957) parodė, kad ląstelėse, užkrėstose gripo virusu, pirmiausia galima pastebėti HA*.
atsiranda visose ląstelės dalyse ir yra lokalizuota perinuklearinėje zonoje padidinta koncentracija. Vėliau HA* kaupiasi blyksnio „periferinėje srityje“, taip pat gali būti demonstruojamas plonais siūlais, kurie išsikiša iš blyksnio membranos.
Idėja, kad apvalkalo komponentai migruoja iš ląstelės vidaus į paviršių, neseniai buvo patvirtinta ir išplėsta atlikus daugybę tyrimų, kuriuose naudojamas ląstelių frakcionavimas ir virusinių baltymų analizė skirtingose ląstelių frakcijose. Šie tyrimai taip pat rodo, kad HA glikoproteinas ir galbūt kiti apvalkalo baltymai yra sintetinami grubiame endoplazminiame tinkle (Compans, 1973a; Klenk ir kt., 1974). Kaip atskleidė impulsų gaudymo eksperimentai, po kelių minučių HA randama lygaus endoplazminio tinklo membranose (Compans, 1973a; Stanley ir kt., 1973; Klenk ir kt., 1974) ir plazmos membranoje (Stanley ir kt. al., 1974). ., 1973). Nors persekiojimo eksperimentai nuo lygaus endoplazminio tinklo iki plazminės membranos nebuvo atlikti, atrodo tikėtina, kad HA migruoja iš šiurkštaus endoplazminio tinklo į plazmos membraną, aplenkdamas lygų endoplazminį tinklą. Pažymėtina, kad per visą tokios migracijos laiką HA ir kiti membraniniai baltymai yra neatskiriamos membranų dalys, kuriomis jie juda; OBI niekada nerandamas kaip ištirpę baltymai.
Lygiose membranos frakcijose, kurios, kaip manoma, pirmiausia gaunamos iš endoplazminio tinklo, randami visi pagrindiniai apvalkalo baltymai (Compans 1973a; Klenk ir kt., 1974). Tačiau jų santykiniai kiekiai skiriasi nuo plazmos membranos ir viriono kiekio (Stanley ir kt., 1973; Klenk ir kt., 1974). M baltymo ir glikoproteino HA santykis yra didesnis subrendusio viriono apvalkale nei endoplazminio tinklo membranose. Šie duomenys rodo, kad tik nedidelis kiekis membranų, turinčių HA glikoproteiną, paverčiamas viruso apvalkalu, būtent membranos frakcijos, kuriose yra baltymų be angliavandenių. Kaip jau buvo nurodyta, M baltymo sintezė gali būti ta stadija, kuri riboja viruso surinkimo procesą.
Skirtingų apvalkalo baltymų sintezės greičio skirtumas patvirtina hipotezę, kad apvalkalo surinkimas yra daugiapakopis procesas. Ši koncepcija atitinka HA* susidarymo proceso klausimą, įskaitant nuoseklų angliavandenių fragmento pridėjimą ir proteolitinis skilimas pirminio geno produkto migracijos metu.
VIII. GRIPO VIRUSO IŠLEIDIMAS
Gripo viruso išlaisvinimo iš ląstelės šeimininkės problema,
Atrodo, kad tai glaudžiai susiję su virusinės funkcijos problema
NA*, kuris jau buvo išsamiai aptartas anksčiau (žr
atvejai V ir sk. 4). Tai, kad šis fermentas vaidina esminį vaidmenį
vaidmuo išskiriant virusą, kilęs iš gebėjimo anti
NA* specifiniai kūnai slopina tokį išsiskyrimą (Se-
iki, Rott, 1966; Webster ir kt. G968). Be to, tokie antikūnai
užkirsti kelią viruso eliuavimui iš eritrocitų (Brown, Laver,
1968). Bakterinė NA*, kurios neslopina antikūnai
lami į virusinę NA*, gali išlaisvinti virusą iš ląstelių,
gydyti tokiais antikūnais (Compans ir kt., 1969;
Webster, 1970). Kita vertus, dvivalenčių antikūnų
NA taip pat sukelia virusų agregaciją (Seto ir Chang, 1969;
Compans ir kt., 1969; Webster, 1970), ir monovalentinis anti
organizmai netrukdo virusui išsiskirti, nors ir slopina
daugiau nei 90 % neuraminidazės aktyvumo (Becht ir kt., 1971).
Visi šie duomenys kartu rodo, kad
dvivalenčiai antikūnai trukdo viruso išsiskyrimui
surišant jį su ant jo esančiais antigenais
ląstelės paviršiuje, ir slopinant fermentų aktyvumą
policininkas. Neuraminidazės vaidmuo išskiriant ekrano virusą
arba Palese ir kt. (G974), kuris nustatė, kad šis fer
yra būtinas norint pašalinti neuroamilo rūgštį iš vi
Rusijos paviršius, kad būtų išvengta virionų agregacijos - vėliau -
kov ant ląstelės paviršiaus.
IX. NENORMALIOS PASAUGINIMO FORMOS
A. ABORTINGAS REPRODUKCIJOS PRIKLAUSOMAS NUO LĄSTELĖS ŠEIMOS
Gripo virusai gali užkrėsti įvairias šeimininkų ląsteles. Tačiau daugelyje užkrėstų ląstelių infekcinių palikuonių išeiga yra labai maža arba neaptinkama, nors viruso komponentus galima aptikti normaliais titrais. Toks nuo šeimininko ląstelės priklausomas infekcinio ciklo pertraukimas vadinamas abortine infekcija. Infekcinis ciklas iš pradžių buvo stebimas pelėms, užkrėstoms neeurotropinėmis gripo viruso padermėmis į smegenis (Schlesinger, 1953). Kuo didesnė viruso dozė, tuo didesnis naujai susintetinto hemagliutinino kiekis. Apibūdintos gripo A viruso sistemos, kuriose buvo gaminamas tik RNP-^ antigenas ir hemagliutininas, bet ne infekcinis virusas. Visose šiose iki šiol tirtose ENT sistemose RNP antigenas kaupėsi branduolyje ir nebuvo aptiktas.
ginkluoti fluorescencinių antikūnų pagalba citoplazmoje (Henle ir kt., 1955; Franklin, Breitenfeld, 1959; Ter Meulen, Love, 1967; Fraser, 1967).
B. VON MAGNUS REIKŠINIS
Serijinio gripo virusų pernešimo metu, kai dažnis didesnis nei 1 (Barry, 1961), susidaro vis daugiau nepilno viruso, išsiskiriančio iš šeimininko ląstelės (von Magnus, 1951, 1952). Šių viruso dalelių paviršiaus struktūra yra labai panaši. infekcinio viruso struktūrą, yra imunogeniški: ir sukelia homologinius trukdžius. Juose yra mažiau RNR ir RNP antigenų, mažesnis užkrečiamumo ir hemagliutinuojančio aktyvumo santykis ir yra daugiau lipidų nei pilnose viruso dalelėse (von Magnus, 1954; Isaacs, 1959; Pauker ir kt., 1959; Rott ir Schafer, 1961; Rott ir Scholtissek, 1963).
Analizuojant dalinio viruso RNR, buvo nustatyta, kad palyginti didelės molekulinės masės virusinės RNR arba nėra, arba jos kiekis yra mažesnis, o mažos molekulinės masės RNR kiekis didėja (Duesberg, 1968; Pons, Hirst, 1969; Nayak, 1969).
Ląstelėse, užkrėstose antruoju nepraskiestu gripo viruso perėjimu, yra visa viruso genetinė informacija, nes iš šių ląstelių išskirta cfRNR po hibridizacijos gali paversti pažymėtą RNR, išskirtą iš infekcinio viruso į visiškai RNR azorezistentišką formą. (Scholtissek, Rott, 1969b). Taigi mažos molekulinės masės RNR kiekio padidėjimą nepilnose dalelėse gali lemti didelės molekulinės masės RNR, kuri gali būti įtraukta į šias daleles sunaikintų, taigi, nefunkcionuojančių molekulių pavidalu. Šią idėją patvirtina duomenys, kad ištroškus neskiestas pasažas pirmiausia sumažėja gebėjimas gaminti infekcinį virusą, o po to sumažėja hemagliutinino, neuraminidazės ir galiausiai RNP antigeno sintezė (Scholtisek ir kt., 1966).
Nayak (1972) nustatė, kad per pirmąjį didelio dauginimosi perėjimą virusas, atsiradęs anksti, buvo visiškai užkrečiamas ir sukūrė normalų infekcinio viruso RNR fragmentų modelį sacharozės gradiente, o vėliau atsiradęs virusas turėjo RNR profilį, būdingą nepilnam ( fonas) -Magnus) virusas1.
- Dihidrotestosteronas vyrams - funkcija, norma ir patologija
- Insulino gavimas: visi pagrindiniai būdai
- Kaip steroidai veikia prostatos liauką Kaip apsaugoti prostatą kurso metu
- Ne virusas, ne baltymas, bet jo pavadinimas yra prionas. Sutrumpintai prionai
- Tinkama mityba sergant skrandžio opalige
- Gydomasis nugaros masažas sergant skolioze Diferencijuotas nugaros masažas 10 15
- Kaip pašalinti skreplius iš bronchų namuose
- Vėžio kaklo augalas. Gyvatės alpinistas. Vėžio kaklo šaknis
- Kokie yra kombucha pranašumai?
- Kas yra dropsija: tipai ir gydymas
- Linų sėklos inkstų gydymui
- Kaip veikia gripo virusas?
- Baltymų perteklius: kuo tai kenksminga?
- Testosterono standartai dopingo kontrolės metu
- Kaip teisingai naudoti atropiną kompleksiniam gydymui Atropino ūkio veiksmas
- Kas yra vyrų hipogonadizmas ir kaip gydyti šią ligą
- Riešo sąnarys yra tobulas viršutinės galūnės motorinis aparatas
- Fosfatidilcholinas – riebalų deginimo injekcijos
- Kada dihidrotestosteronas yra padidėjęs moterims ir vyrams?
- Dieta skydliaukės tirotoksikozei Kokie maisto produktai neleidžiami tirotoksikozei