Produktion och användning av svavel. Beskrivning av svavel. Fysikaliska egenskaper hos svavel
Svavel och dess föreningar är bland de viktigaste klasserna av bekämpningsmedel.
Svavel är ett gult fast ämne. Det finns kristallina och amorfa varianter. Svavel löser sig inte i vatten, det löser sig bra i koldisulfid, anilin, fenol, bensen, bensin och dåligt i alkohol och kloroform. Vid förhöjda temperaturer kombineras det med syre, metaller och många icke-metaller. Finns i form av 80-90% vätpulver, 70-75% kolloidalt svavel och malt svavel.
Malet svavel löses inte i vatten och fuktas dåligt av det.
Kolloidalt svavel Den är väl fuktad med vatten och skapar, när den skakas eller rörs om, ihållande grumliga suspensioner. Avdunstar svagt och långsamt.
Tillverkad och transporterad i metall- och trätunnor; och även i papperspåsar behandlade med ett vattentätt ämne. När det förvaras i lösa behållare torkar kolloidalt svavel ut, förvandlas till klumpar och blandas sedan mycket dåligt med vatten.
Inom boskapsuppfödningen används kolloidalt svavel för att bekämpa psoroptos hos nötkreatur genom att bespruta djur med en 3% vattensuspension med en konsumtion av 3-4 liter per djur, två gånger, med ett intervall på 7-10 dagar.
Svavel är lågt giftigt. Akut förgiftning vid arbete med den är utesluten. Långvarig inandning kan dock orsaka andningsproblem.
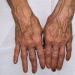
Svavelsticklingar- smält svavel förvandlats till en cylindrisk form. Belyst. När 1,4 g förbränns erhålls 1 liter svaveldioxid. Den antiparasitiska effekten av svavel beror på bildningen av svaveldioxid, vätesulfid, syre, i närvaro av fukt, alkalier och organiska föreningar. I koncentrationer på 5-8% har svavel en mjukgörande, keratoplastisk, antiinflammatorisk effekt och en svag anti-skabb, och i höga koncentrationer, på grund av bildning av svavelsyra och svavelsyra, utvecklas irriterande, uttorkande och keratolytiska effekter. Svavelsticklingar används för att behandla djur som lider av skabb, trikofytos, mikrosporia, furunkulos, seborré, eksem, dermatit i form av 10-30% renad svavelsalva eller 5-10 och 20% utfälld svavelsalva, såväl som i formen av liniment och damm.
För att behandla skabb, använd svavelsalva (svavel 6 delar, grön tvål - 8, kaliumkarbonat - 1 och vaselin - 10 delar).
Renat svavel- svavel, fritt från alla föroreningar, tillverkas i pulverform i noggrant tillslutna behållare. Renat svavel har en antiparasitisk och antidot effekt mot många förgiftningar. Det används i alla fall som skärande svavel.
Svavel utfälldes- renad från många föroreningar. Belyst. Vid förbränning bildas svaveldioxid, som har antiparasitiska och insekticida effekter. Farmakodynamik och verkningsmekanism är desamma som för skärande svavel. Finns i pulverform, i väl tillslutna burkar.
Natriumsulfat- ett svavelhaltigt ämne med antiparasitisk effekt. Verkningsmekanismen är bildandet av svaveldioxid och svavel under interaktionen av natriumtiosulfatmolekyler med en molekyl av syror eller sura salter, som ett resultat av vilket redoxprocesserna i parasiterna förändras kraftigt.
Den tillverkas i pulverform, som måste förvaras i en väl tillsluten behållare.
Demos- ett akaricidalt läkemedel, som inkluderar svavel och hjälpkomponenter. Detta är ett ljusbrunt liniment med en svag specifik lukt. Läkemedlet tillverkas i glas- eller plastflaskor med en kapacitet på 10, 15 och 20 ml. Förvara demos vid en temperatur på 0-25°C på en plats skyddad från ljus. Hållbarhet - 2 år från tillverkningsdatum.
Demos är aktivt mot sarkoptoidkvalster - de orsakande medlen för psoroptisk skabb hos kaniner, otodektisk skabb hos köttätare, notoedros hos katter, såväl som mot orsaken till demodikos hos hundar.
Läkemedlet har låg toxicitet för varmblodiga djur, det har ingen irriterande eller sensibiliserande effekt.
När du behandlar djur med öronskabb, rengör först öronen noggrant från sårskorpor med en bomullspinne indränkt i kamferalkohol, injicera sedan 1,5-3,0 ml demos i öronen med hjälp av en pipett och massera lätt över öronen vid basen. Om andra delar av kroppen påverkas, gnuggas läkemedlet in i de drabbade områdena med en bomullspinne med en hastighet av 0,1-0,3 cm av intilliggande frisk hud.
Djur med stora ytor av hudskador behandlas i 2 doser, med ett intervall på 1 dag, applicera läkemedlet först på ena halvan och sedan på den andra halvan av den drabbade ytan av kroppen.
Plison(difenyldisulfid), C12H10S2. Erhålls genom att blanda kololja 22-42%, difenylsulfid 6-10%, emulgeringsmedel OP-7 (kolofonium) eller OP-10 (neonol) - 15-20% och vatten upp till 100%. Difenyldisulfid produceras som en biprodukt vid produktion av stenkolstjärfenoler.
Plizon är en homogen, mörkfärgad oljig vätska. Den vattenhaltiga emulsionen av detta läkemedel är stabil i 4 timmar vid rumstemperatur. Läkemedlet är lågtoxiskt, när det appliceras kutant är LD50 12 500 mg/kg. 0,5 % plisonemulsion (terapeutisk koncentration) tolereras väl av får och åtföljs inte av förändringar i den morfologiska bilden av blodet. Plizon 2% orsakar en minskning av aktiviteten av kolinesteras och alkaliskt fosfatas den första dagen efter köpet, utan manifestation av kliniska tecken på toxicos.
Plizon, enligt forskning av O.D. Yanyshevsky et al., utsöndras från inre organ och vävnader hos får som behandlats med en 0,5 % emulsion efter 40 dagar och från fett efter 65. Hos djur som behandlats med en 0,25 % plisonemulsion saknades difenyldisulfid i de inre organen och vävnader efter 20 dagar. Den kvarstår på fårull i upp till 5 månader i en mängd av 15,1 mg/kg. Det utsöndras inte i mjölken från diande tackor.
Lepran- en svavelhaltig produkt från bearbetning av bensotiofenstenkolstjära. Vätskan är mörkbrun med doften av kololja. När den blandas med vatten bildar lepran en stabil ljusbrun emulsion. Läkemedlet består av bensotiofen - 10-14%, kololja 57-64, emulgeringsmedel 25-30 och vatten upp till 100%. Lepran är lågtoxisk, dess LD50 vid köp av får är 14250 mg/kg. Kumuleringskoefficienten är mer än 5,28, vilket indikerar svaga kumulativa egenskaper, och har inte allergiframkallande eller irriterande egenskaper för hud och slemhinnor. Vid behandling av får (engångsköp) med 2% lepranemulsion (0,22% DDV), enligt forskning av B.A. Timofeev, läkemedlet har inte mutagena egenskaper, ändrar inte hematologiska parametrar för fosfatas, veterinära och sanitära indikatorer för kvaliteten på fårkött. 50 dagar efter behandlingen detekteras inte bensotiofen i fårens organ och vävnader, köttet är lämpligt för frisättning och försäljning för livsmedelsändamål. Bensotiofen utsöndras inte i mjölk, läkemedlet kan användas för att behandla dräktiga och lakterande får.
I fall av förgiftning av djur med svavelhaltiga läkemedel används aktivt kol, bränd magnesia och ett laxermedel internt.
I VIA-gruppen är svavel också ett allmänt känt och utbrett kemiskt grundämne i naturen. I jordskorpan finns svavel i form av ett antal mineraler som bildar rika avlagringar. Inhemskt svavel finns ofta, d.v.s. enkel substans S (S 8). Svavelföreningar med metaller är mycket vanliga. Många av dem är mest värdefulla som malmer för framställning av metaller: blyglans PbS, zinkblandad ZnS, kopparglans CuS, etc. Mineralkisen FeS 2 (järnkis), som bildar kubiska kristaller av mässingsfärg, fungerar huvudsakligen som en råmaterial för framställning av svavelsyra.
Vissa sulfater är också utbredda. Mineralerna gips och anhydrit (kristallint hydrat CaS0 4 2H 2 0 och vattenfritt kalciumsulfat) bildar på sina ställen hela berg. Magnesium och natriumsulfater finns i havsvatten. Transparenta kristaller bildas av strontiumsulfat SrS0 4 - celestine. Baryt, eller heavy spar BaS0 4, används flitigt för tillverkning av vitt och som fyllmedel inom pappers- och gummiindustrin. Till exempel appliceras ett lager av baryt på fotografiskt papper. Kol innehåller betydande mängder svavel och när det förbränns kommer det ut i atmosfären. Oxiden cepbi(IV) SO 2 finns konstant i luften. Om detta svavel utvanns från kolförbränningsprodukter skulle det vara möjligt att kraftigt minska produktionen av traditionella svavelmalmer. Samtidigt skulle de skadliga effekterna av S0 2 på vegetation och sötvattenförekomster minska. Svavel finns alltid i proteiner, eftersom aminosyrorna cystein och metionin innehåller svavel. Den totala massan av svavel i människokroppen är 120 g.
Världsproduktionen av svavel överstiger 60 miljoner ton. Mer än hälften av denna mängd används för produktion av svavelsyra och resten för produktion av sulfiter, gummi och skadedjursbekämpningsprodukter inom jordbruket.
Naturligt svavel består av fyra stabila isotoper, där 95 % av denna blandning är isotopen
När det gäller kemiska egenskaper visar svavel inte signifikanta likheter med syre. Det viktigaste som sammanför dessa två grundämnen är det tvåvärda tillståndet i föreningar med de flesta kemiska grundämnen. Det bör noteras att i föreningar mellan syre och svavel förblir syre tvåvärt, och svavel kan vara fyra- eller sexvärt. Högre valenstillstånd för svavel är möjliga på grund av närvaron
gratis 3
En av de viktiga och karakteristiska egenskaperna hos svavelatomer är förmågan att bilda kedjor:

Om syreatomer kombineras till kedjor med mer än tre atomer (i en ozonmolekyl), så ger svavel under vissa förhållanden kedjor på hundratusentals atomer. Två sammankopplade svavelatomer -8-8- fungerar ofta som en brygga i en proteinmolekyl.
Svavel. Enkla ämnen
Svavel som ett enkelt ämne bildar flera varianter. Vanligt svavel är ett gult, kristallint, sprödt ämne som kallas rombiskt svavel. Vackra kristaller av naturligt svavel finns på platser där vulkaniska gaser kommer fram (Kamchatka, Kurilöarna). Rombiskt svavel, stabilt under normala förhållanden, smälter vid 112,8°C. Men flytande svavel vid 119°C börjar kristallisera i form av mörkgula nålformade kristaller av ett monokliniskt system. Således bildar svavel två olika fasta faser, men under 112,8°C är ortorombiskt svavel stabilt. Kokpunkten för svavel är 444,6°C. Svavel är olösligt i vatten, men lösligt i koldisulfid och bensen.
Fast svavel och dess lösningar består av molekyler 8 8 . Dessa är ringmolekyler formade som en krona (fig. 19.3).

Ris. 19.3.
När man skriver kemiska reaktioner tar man vanligtvis inte hänsyn till svavlets molekylstruktur och skrivs i form av atomer. Över smältpunkten mörknar svavel gradvis och förvandlas vid ~250°C till en trögflytande massa av rödbrun färg, bestående av mycket långa kedjor på 8 R.
Över 300°C blir svavel återigen en rörlig vätska. Kokande svavel producerar orangegula ångor. Svavelånga innehåller molekylerna B 8, 5 b, 8 4 och $ 2. Molekylerna 5 2 är i struktur nära syremolekylerna 0 2.
Om smält svavel, upphettat till kokning, hälls i kallt vatten (fig. 19.4), förvandlas det till en brun, mjuk, gummiliknande massa som sträcker sig till trådar. Denna typ av svavel kallas plastgrå. Den består av zigzag mycket långa molekyler B, där P når 100 000 eller mer. Efter en kort tid blir plastsvavel sprött, får en gul färg och övergår gradvis till rombiskt svavel 5 8 .

Ris. 19.4.
Svavel utvinns direkt från naturliga avlagringar. Det extraherade svavlet destilleras för rening i speciella raffineringsugnar. Först kommer svavelånga in i en stor tegelkammare. På kalla väggar faller svavel ut i form av ett ljusgult pulver som kallas svavelfärg. På heta väggar vid en temperatur av cirka 120°C förvandlas svavlet till en vätska, som släpps ut i träformar, där det härdar i form av pinnar. Svavlet som erhålls på detta sätt kallas Cherenkova.
Det finns också många kända reaktioner där svavel frigörs från komplexa ämnen. Svavel bildas genom att blanda gasformigt svavelväte och seionisk gas:
Förbränning av vätesulfid under förhållanden med syrebrist leder också till bildning av svavel (se nedan).
Oxider av svavel (IE) och kol (H) reagerar för att frigöra svavel i närvaro av en katalysator:
Denna reaktion används för att rena bränsleförbränningsprodukter från svavelföroreningar.
Svavel kan erhållas genom reaktion i en vattenlösning. När saltsyra tillsätts till en lösning av natriumtiosulfat Na 2 5 2 0 3 blir vätskan grumlig och ljusgult fint svavel fälls gradvis ut:
Kemiska omvandlingar av svavel sker främst vid uppvärmning. Utan deltagande av andra reagenser bildar svavel ett antal olika molekyler:
Svavel kombineras med nästan alla icke-metaller och metaller. Reaktion; väte reversibel:
![]()
Svavel reagerar med halogener och bildar föreningar i två- och fyrvärt tillstånd. Endast med fluor i överskott bildas den gasformiga stabila föreningen BR 6.
I luft och syre brinner svavel med en blå låga:

När svavel brinner överstiger temperaturen 800°C, vilket resulterar i att jämvikten i den andra reaktionen förskjuts kraftigt åt vänster och endast ~5% svavel omvandlas till $0 3.
Svavel reagerar med metaller med stor värmeavgivning. När en blandning av svavel- och zinkpulver antänds uppstår en ljus blixt. Vit zinksulfid bildas:
Svavel reagerar lättare med vissa ^-element i den 5:e och 6:e perioden än syre. Silver är motståndskraftigt mot syre, men när det blandas med svavel utan upphettning bildar det brun sulfid:
![]()
Svavel reagerar med oxider, syror och salter som uppvisar starka oxiderande egenskaper:

Vid upphettning med en alkalilösning reagerar svavel på samma sätt som halogener, d.v.s. disorportioner:
Svavelatomer från ett enkelt ämne kan fästa till svavel i vissa komplexa ämnen:
I det resulterande polysulfid natrium innehåller kedjor av svavelatomer med negativ laddning i ändarna:

En lösning av natriumsulfit reagerar med svavel när den kokas:
Den resulterande färglösa lösningen innehåller salt tiosvavel syror - natriumtiosulfat.
DEFINITION
Svavel- det sextonde elementet i det periodiska systemet. Beteckning - S från latinets "svavel". Belägen i den tredje perioden, grupp VIA. Avser icke-metaller. Kärnladdningen är 16.
Svavel förekommer i naturen både i fritt tillstånd (nativt svavel) och i olika föreningar. Svavelföreningar med olika metaller är mycket vanliga. Många av dem är värdefulla malmer (till exempel blyglans PbS, zinkblandad ZnS, kopparglans Cu 2 S) och fungerar som en källa för icke-järnmetaller.
Bland svavelföreningar är sulfater också vanliga i naturen, främst kalcium och magnesium, Slutligen finns svavelföreningar i växters och djurs organismer.
Atom- och molekylmassa av svavel
Relativ molekylvikt för ämnet (Mr)är ett tal som visar hur många gånger massan av en given molekyl är större än 1/12 av en kolatoms massa, och relativ atommassa för ett grundämne(A r) - hur många gånger den genomsnittliga massan av atomer i ett kemiskt element är större än 1/12 massan av en kolatom.
Värdena för atom- och molekylmassan av svavel är desamma; de är lika med 32,059.
Allotropi och allotropa modifieringar av svavel
Svavel finns i form av två allotropa modifieringar - ortorombisk och monoklinisk.
Vid normala tryck bildar svavel sköra gula kristaller som smälter vid 112,8 o C; densiteten är 2,07 g/cm3. Det är olösligt i vatten, men ganska lösligt i koldisulfid, bensen och några andra vätskor. När dessa vätskor avdunstar frigörs svavel från lösningen i form av gula kristaller i det ortorhombiska systemet, i form av oktaedrar, i vilka vanligtvis några av hörnen eller kanterna är avskurna (fig. 1). Denna modifiering av svavel kallas rombisk.
Ris. 1. Allotropa modifieringar av svavel.
Kristaller av annan form erhålls om smält svavel långsamt kyls ned och, när det delvis stelnar, dräneras vätskan som ännu inte hunnit stelna. Under dessa förhållanden är kärlets väggar täckta från insidan med långa mörkgula nålformade kristaller av det monokliniska systemet. Denna modifiering av svavel kallas monoklinisk. Den har en densitet på 1,96 g/cm3, smälter vid 119,3 o C och är stabil endast vid temperaturer över 96 o C.
Svavelisotoper
Det är känt att svavel i naturen kan hittas i form av fyra stabila isotoper 32 S, 33 S, 34 S och 36 S. Deras massatal är 32, 33, 34 respektive 36. Kärnan i en atom i svavelisotopen 32 S innehåller sexton protoner och sexton neutroner, och isotoperna 33 S, 34 S och 36 S innehåller samma antal protoner, sjutton, arton respektive tjugo neutroner.
Det finns konstgjorda isotoper av svavel med masstal från 26 till 49, bland vilka den mest stabila är 35 S med en halveringstid på 87 dagar.
Svaveljoner
Den yttre energinivån hos svavelatomen har sex elektroner, som är valenselektroner:
1s 2 2s 2 2p 6 3s 2 3p 4 .
Som ett resultat av kemisk interaktion kan svavel förlora sina valenselektroner, d.v.s. vara deras donator, och förvandlas till positivt laddade joner eller ta emot elektroner från en annan atom, d.v.s. vara deras acceptor och förvandlas till negativt laddade joner:
SO-6e → S6+;
SO-4e → S4+;
SO-4e → S2+;
So+2e → S2-.
Svavelmolekyl och atom
Svavelmolekylen är monoatomisk - S. Här är några egenskaper som kännetecknar svavelatomen och molekylen:
Exempel på problemlösning
EXEMPEL 1
| Träning | Vilken massa svavel kommer att krävas för att få aluminiumsulfid Al 2 S 3 som väger 30 g? Under vilka förhållanden kan denna sulfid erhållas från enkla ämnen? |
| Lösning | Låt oss skriva reaktionsekvationen för produktionen av svavelsulfid: 2Al + 3S = Al2S3. Låt oss beräkna mängden aluminiumsulfid (molmassa - 150 g/mol): n(Al2S3) = m(Al2S3)/M(Al2S3); n(Al2S3) = 30/150 = 0,2 mol. Enligt reaktionsekvationen n(Al 2S 3): n(S) = 1:3 betyder det: n(S) = 3 x n(Al2S3); n(S) = 3 x 0,2 = 0,6 mol. Då blir svavelmassan lika stor (molmassa - 32 g/mol): m(S) = n(S) x M(S); DEFINITION Svavel– element i den tredje perioden av VIA-gruppen, tillhör familjen av p-element. Serienummer 16. Elektronkonfigurationen är 1s 2 2s 2 2p 6 3s 2 3p 4. Symbolen är S. Relativ atommassa – 32 amu. Kokpunkt – 444.67C, smältpunkt – 112.85C. Icke-metall. Kemiska egenskaper hos svavelSvavel interagerar med enkla ämnen - icke-metaller, som uppvisar egenskaperna hos ett reduktionsmedel. Svavel interagerar direkt endast med fluor. Reaktioner av interaktion med andra metaller uppstår vid upphettning: S + F2 = SF6; 2S + Cl2 = S2CI2; S + Cl2 = SCI2; 5S + 2P = P2S5; S + H2 = H2S; S + O2 = SO2; 2S + Br 2 = S 2 Br 2. I reaktioner av interaktion med enkla ämnen - metaller, uppvisar svavel egenskaperna hos ett oxidationsmedel. Dessa reaktioner uppstår vid upphettning och är mycket våldsamma: 2Na + S = Na2S; 2Al + 3S = AI2S3; Svavel reagerar med komplexa ämnen. Det kan lösas i koncentrerade syror och smälta alkalier, och i det senare fallet är svavel oproportionerligt. Dessa reaktioner inträffar när reaktionsblandningen kokar: 3S + 6KOH = K2SO3 + 2K2S + 3H2O; S + 6HNO3 = H2SO4 + 6NO2 + 2H2O; S + 2H2SO4 = 3SO2 + 2H2O. När svavel reagerar med metallsulfider bildas polysulfider: Na2S + S = Na2S2. Fysikaliska egenskaper hos svavelSvavel är ett gult kristallint ämne. Det finns i form av två allotropa modifieringar - α-svavel (ortorombiskt kristallgitter) och β-svavel (monoklint kristallgitter), såväl som en amorf form - plastsvavel (Fig. 1). I det kristallina tillståndet byggs svavel från icke-plana cykliska S8-molekyler. Svavel är dåligt lösligt i etanol, men lösligt i koldisulfid och flytande ammoniak. Reagerar inte med flytande vatten och jod. Ris. 1. Former för existens av svavel. Produktion och användning av svavelI industriell skala erhålls svavel från naturliga avlagringar av naturligt svavel. Svavel är råvaran för tillverkning av svavelsyra. E1 används inom pappersindustrin, lantbruket, gummi, färgämnen, krut mm. Svavel har fått bred användning inom medicin, till exempel ingår svavel i olika salvor och pulver som används för hudsjukdomar, etc. Exempel på problemlösningEXEMPEL 1 SVAVEL Upplösning av svavel Svavel, som är känt för att vara olösligt i vatten och löser sig i små mängder i bensen, alkohol eller eter, är perfekt lösligt i koldisulfid cs2. Om du långsamt avdunstar en lösning av en liten mängd svavel i koldisulfid på ett klockglas får du stora kristaller av det så kallade rombiska eller a-svavlet. Men låt oss inte glömma brännbarheten och toxiciteten hos koldisulfid, så låt oss stänga av alla brännare och placera klockglaset under draget eller framför fönstret. En annan form - monoklinisk eller b-cepa - kan erhållas genom att tålmodigt kristallisera nålar ca 1 cm långa från toluen (toluen är också brandfarligt!). Tillverkning av svavelväte och experiment med det Placera lite (ungefär lika stor som en ärta) av den resulterande järnsulfiden i ett provrör och tillsätt utspädd saltsyra. Ämnen interagerar med våldsamma gasutsläpp: fes + 2hcl = h2s + fecl2 En obehaglig lukt av ruttna ägg kommer från provröret - det här är svavelväte som avdunstar. Om du passerar det genom vatten kommer det att lösas upp delvis. En svag syra bildas, vars lösning ofta kallas svavelvätevatten. Ytterst försiktighet måste iakttas när man arbetar med svavelväte, eftersom gasen är nästan lika giftig som cyanväte hcn. Det orsakar förlamning av luftvägarna och dödsfall om koncentrationen av svavelväte i luften är 1,2-2,8 mg/l. Kemiskt detekteras svavelväte med vått blyreagenspapper. För att få det fuktar vi filterpapper med en utspädd lösning av blyacetat eller nitrat, torkar det och skär det i remsor 1 cm breda.Svavelväte reagerar med blyjoner, vilket resulterar i bildandet av svart blysulfid. Denna metod kan detektera svavelväte i bortskämda livsmedel (ägg, kött). Vi rekommenderar att man tillverkar svavelväte med den torra metoden, eftersom gasflödet i detta fall enkelt kan justeras och stängas av vid rätt tidpunkt. För detta ändamål, smält cirka 25 g paraffin i en porslinskopp och blanda 15 g svavel med smältan. Ta sedan bort brännaren och rör om blandningen tills den stelnar. Mal den fasta massan och spara den för ytterligare experiment. När det är nödvändigt att få vätesulfid värmer vi flera bitar av en blandning av paraffin och svavel i ett provrör till en temperatur över 170°C. När temperaturen stiger ökar gasuttaget och om brännaren tas bort stannar den. Under reaktionen interagerar paraffinväte med svavel, vilket resulterar i att svavelväte bildas, och kol blir kvar i provröret, till exempel: c40h82 + 41s = 41h2s + 40c Vi får sulfider För att undersöka färgen på utfällda metallsulfider, låt oss passera vätesulfid genom lösningar av olika metallsalter. Sulfider av mangan, zink, kobolt, nickel och järn fälls ut om en alkalisk miljö skapas i lösningen (till exempel genom att tillsätta ammoniumhydroxid). Bly, koppar, vismut, kadmium, antimon och tennsulfider kommer att fällas ut i saltsyralösningen. Svavelväteförbränning Efter att ha gjort ett preliminärt test för att detonera gas, låt oss tända vätesulfiden som kommer ut ur ett glasrör som dras i slutet. Svavelväte brinner med en blek låga med en blå halo: ЗН2s + ЗО2 = 2h2o + 2so2 Som ett resultat av förbränning bildas svaveloxid (iv) eller svaveldioxid. Det är lätt att identifiera genom sin stickande lukt och rodnaden av vått blått lackmuspapper. Om det inte finns tillräcklig tillgång till syre oxideras svavelväte endast till svavel. Aktivt kol accelererar katalytiskt denna process. Denna metod används ofta för finrening av industrigaser, vars svavelhalt inte bör överstiga 25 g/m3: 2h2s + O2 = 2H2O + 2s Det är inte svårt att reproducera denna process. Installationsschemat visas i figuren. Det viktigaste är att passera luft och svavelväte genom aktivt kol i förhållandet 1: 3. Gult svavel kommer att frigöras på kolet. Aktivt kol kan rengöras från svavel genom att tvätta det i koldisulfid. Inom tekniken används oftast en lösning av ammoniumsulfid (nh4)2s för detta ändamål. Experiment med svavelsyra Svaveloxid (iv) - svaveldioxid - är extremt löslig i vatten, vilket resulterar i bildning av svavelsyra: h2o + so2 = h2so3 Det dödar bakterier och har en blekande effekt; I bryggerier och vingårdar desinficeras fat med svavel. Svaveldioxid används också för att bleka flätade korgar, blöt ull, halm, bomull och siden. Fläckar Från blåbär, till exempel, elimineras de om du håller ett fuktigt, förorenat område i "ångan" av brinnande svavel under lång tid. Låt oss kontrollera blekningseffekten av svavelsyra. För att göra detta, låt oss sänka cylindern, där svavelbitar har brunnit en tid, i olika färgade föremål (blommor, våta tygbitar, viktigt lackmuspapper etc.), täck cylindern väl med en glasskiva och vänta ett tag. Alla som någonsin har studerat grundämnenas atomstruktur vet att svavelatomen har sex så kallade valenselektroner i sin yttre omloppsbana. Därför kan svavel vara maximalt hexavalent i föreningar. Detta oxidationstillstånd motsvarar svaveloxid (vi) med formeln so3. Det är en svavelsyraanhydrid: h2o + so3 = h2so4 När svavel förbränns under normala förhållanden bildas alltid svaveloxid (iv). Och om en viss mängd svaveloxid (vi) bildas, sönderdelas den oftast omedelbart under påverkan av värme till svaveloxid (iv) och syre: 2so3 = 2so2 + o2 Vid produktion av svavelsyra är huvudproblemet omvandlingen av sO2 till so3. För detta ändamål används nu två metoder: kammare (eller förbättrat - torn) och kontakt. (se experiment "Beredning av svavelsyra) Beredning av svavelsyra Kammarmetod
När kolven är fylld med gas, stäng den med en propp med tre hål. I en, som visas i figuren, sätter vi in ett glasrör böjt i rät vinkel, anslutet till sidoutloppet på provröret, i vilket kväveoxid bildas när bitar av koppar och salpetersyra interagerar (iv): 4hno3 + Сu = cu(no3)2 + 2h2o + 2no2 Syrakoncentrationen bör vara ca 60 % (vikt). Uppmärksamhet! no2 är ett starkt gift! I ett annat hål kommer vi att föra in ett glasrör kopplat till provröret, genom vilket vattenånga senare kommer att strömma. I det tredje hålet sätter vi in en kort bit rör med en Bunsen-ventil - en kort bit gummislang med en slits. Låt oss först skapa ett starkt inflöde av kväveoxid i kolven. (Varning! Gift!) Men det finns ingen reaktion än. Kolven innehåller en blandning av brunt no2 och färglöst so2. Så snart vi passerar vattenånga kommer en färgförändring att indikera att reaktionen har börjat. Under påverkan av vattenånga oxiderar kväveoxid (iv) svaveloxid (iv) till svaveloxid (vi), som omedelbart, interagerar med vattenånga, förvandlas till svavelsyra: 2no2 + 2so2 = 2no + so3 Färglöst kondensat samlas i botten av kolven, och överskottsgas och ånga kommer att strömma ut genom Bunsenventilen. Låt oss hälla den färglösa vätskan från kolven i ett provrör, kontrollera den sura reaktionen med lackmuspapper och detektera sulfatjonen so42- av den resulterande svavelsyran genom att tillsätta en lösning av bariumklorid. En tjock vit fällning av bariumsulfat kommer att indikera för oss att experimentet var framgångsrikt. Enligt denna princip, men i mycket större skala, produceras svavelsyra i teknik. Tidigare var reaktionskammarna klädda med bly, eftersom det är resistent mot svavelsyraånga. I moderna torninstallationer används keramiska reaktorer. Men större mängder svavelsyra produceras nu med kontaktmetoden. Kontaktmetod
4fes2 + 11O2 = 3fe2o3 + 8so2 Den resulterande järn(iii)oxiden avlägsnas från ugnen som glödskal och bearbetas vidare i järnproduktionsanläggningar. Krossa flera bitar av pyrit i en mortel och placera dem i ett eldfast glasrör, som vi stänger med en propp med ett hål. Använd sedan en brännare för att värma upp röret kraftigt, samtidigt som luft passerar genom det med en gummilampa. För att det flyktiga dammet från stekgasen ska sedimentera, tar vi det in i ett tomt glaskärl och från det till ett andra eldfast rör, som innehåller en katalysator uppvärmd till 400-500 °C. Inom tekniken används vanadin(v)oxid v2o5 eller natriumvanadate navo3 oftast som katalysator, och för detta ändamål kommer vi att använda röd järnoxid (iii) fe2O3. Applicera finmalen järnoxid på glasull som vi fördelar i ett rör i ett 5 cm långt lager Värm röret med katalysatorn tills det når röd värme. På katalysatorn interagerar svaveloxid (iv) med atmosfäriskt syre; som ett resultat bildas svaveloxid (vi). 2so2 + o2 = 2so3 som vi utmärker oss genom dess förmåga att bilda dimma i fuktig luft. Samla upp so2 i en tom kolv och skaka kraftigt och blanda med en liten mängd vatten. Vi kommer att få svavelsyra - vi kommer att bevisa dess närvaro, som i föregående metod. Du kan också placera glasull och katalysator separerade i ett av glasrören. Du kan också arbeta i ett provrör med sidoutlopp. Låt oss lägga pyrit på provrören, ett lager glasull på det och sedan glasull med en katalysator. Vi inför luft från ovan i röret, som ska passa nära katalysatorn. På sidogrenen kommer vi att fästa ett i vinkel böjt rör som leder in i provröret. Om det inte finns någon pyrit, kommer vi i ett provrör med sidoutlopp att få svaveloxid (iv) från natriumsulfit eller hydrosulfit av svavelsyra och sedan passera den resulterande gasen över katalysatorn tillsammans med en ström av luft eller syre. Kromoxid (III) kan också användas som katalysator, som bör brännas i en järndegel och finfördelas i en mortel. För samma ändamål kan du blötlägga en lerskärva med en lösning av järn(ii)sulfat och sedan kraftigt kalcinera den. I detta fall bildas ett fint pulver av oxidjärn (iii) på leran. Syra från gips Om det finns få metallsulfider (som t.ex. i Tyskland) kan utgångsprodukterna för tillverkning av svavelsyra vara caso4-anhydrit och caso4-h2o-gips. Metoden för att erhålla svaveloxid (iv) från dessa produkter utvecklades av Müller och Kuehne för 60 år sedan.
caso4 + 2c = cas + 2co2 cas + 3caso4 = 4cao + 4so2 Det är möjligt att sönderdela kalciumsulfat i laboratorieförhållanden endast när man använder lämplig hög temperatur. Vi kommer att arbeta med utrustning liknande den som användes för eldning av pyrit, bara vi tar ett porslins- eller järnrör för förbränning. Stäng röret med pluggar inslagna i asbesttyg för värmeisolering. Vi kommer att sätta in en kapillär i hålet i den första pluggen, och i den andra, ett enkelt glasrör, som vi kommer att ansluta med en tvättflaska till hälften fylld med vatten eller en fuchsinlösning. Låt oss förbereda reaktionsblandningen enligt följande. Mal 10 g gips, 5 g kaolin (lera) och 1,5 g aktivt kolpulver i en mortel. Torka blandningen genom att värma den en stund till 200 °C i en porslinsmugg. Efter kylning (helst i en exsickator), tillsätt blandningen i mitten av förbränningsröret. Var samtidigt uppmärksam på att den inte fyller hela rörets tvärsnitt. Sedan värmer vi röret kraftigt med två brännare (en underifrån, den andra snett ovanifrån) och när röret värms upp passerar vi ett inte för starkt luftflöde genom hela systemet. Inom 10 minuter, på grund av bildningen av svavelsyra, kommer fuchsinlösningen i tvättflaskan att bli missfärgad. Stäng av vattenstrålepumpen och stoppa uppvärmningen. Vi kan också få hög temperatur om vi lindar ett porslinsrör så hårt som möjligt med en 750-1000 W värmeslinga (se figur). Vi ansluter spiralens ändar med tjock koppartråd, som vi också lindar runt röret många gånger, och sedan isolerar det med porslinspärlor och ansluter det till pluggen. (Var försiktig när du arbetar med 220 V!) En glasfackla eller blåslampa kan naturligtvis också vara användbar som värmekälla. Tekniken fungerar med en blandning av anhydrit, koks, lera, sand och pyritcinder fe2o3. En snäcktransportör levererar blandningen till en 70 meter lång roterande rörugn, där det pulveriserade kolet bränns. Temperaturen i slutet av ugnen, vid förbränningsplatsen, är cirka 1400 °C. Vid denna temperatur smälts den brända kalken som bildas under reaktionen med lera, sand och pyritcinder för att bilda cementklinker. Den kylda klinkern mals och blandas med några procent gips. Det resulterande högkvalitativa Portlandcementet säljs. Med noggrann implementering och kontroll av processen, från 100 ton anhydrit (plus lera, sand, koks och pyritcinder) kan du få cirka 72 ton svavelsyra och 62 ton cementklinker. Svavelsyra kan också erhållas från kieserit (magnesiumsulfat mgso4 -H2O). För experimentet kommer vi att använda samma uppställning som för nedbrytning av gips, men den här gången tar vi ett rör av eldfast glas. Vi erhåller reaktionsblandningen genom att kalcinera 5 g magnesiumsulfat i en porslinsskål och 0,5 g aktivt kol i en järndegel med lock och sedan blanda dem och växa i en mortel till ett dammigt tillstånd. Överför blandningen till en porslinsbåt och placera den i reaktionsröret. Den vita massan som kommer att erhållas i slutet av experimentet i en porslinsbåt består av magnesiumoxid. Inom tekniken bearbetas det till Sorel-cement, som är grunden för framställning av xyolit. Tillverkningen av derivatprodukter som cementklinker och xylolit, som är viktiga för byggindustrin, gör tillverkningen av svavelsyra från lokala råvaror särskilt ekonomisk. Att bearbeta intermediärer och biprodukter till värdefulla råvaror eller slutprodukter är en viktig princip för den kemiska industrin. Låt oss hämta xyolit Blanda lika delar magnesiumoxid och sågspån med en lösning av magnesiumklorid och applicera ett lager av den resulterande slurryn ca 1 cm tjockt på underlaget. Efter 24-48 timmar kommer massan att stelna som sten. Det brinner inte, det går att borra, såga och spika. Vid byggande av hus används xyolit som golvmaterial. Träfiber, härdad utan att fylla luckorna med Sorel-cement (magnesiumcement), pressad och limmad till plattor, används som ett lätt, värme- och ljudtätt byggmaterial (Heraclitus-plattor). Redaktörens val
I de flesta fall är utbuktande vener i armarna normen, inte en patologi. Oftare observeras kärl på mäns händer och underarmar....
Naturlig eller handskördad från aminosyror. Egenskaperna och resultaten av användningen av sådana peptidläkemedel manifesteras i normaliseringen ...
Upptäckten av en metod för att producera muskeltillväxthormon skedde på 70-talet av 1900-talet. Den var isolerad från hjärnorna på lik. Somatotropin var mycket...
Idag är olika droger och kosttillskott ganska populära bland idrottare för att förbättra prestanda, bättre...
Pistasch är ett litet släkte av vintergröna eller lövträd eller buskar av familjen Sumacaceae, fördelade i subtropiska...
Kreatin är ett ämne i skelettmuskler, myokard och nervvävnad. I form av kreatinfosfat är kreatin en "depå" av högenergibindningar,...
Gikt är en sjukdom som orsakas av en störning av purinmetabolismen. Det bestäms av närvaron av ökade nivåer av urinsyra i blodet, och...
Obehag och smärta under manuell manipulation indikerar ett möjligt problem. Att tejpa armbågsleden förbättrar avsevärt...
Echinacea är en blommande växt hemma i Nordamerika. Indianer har alltid använt det...
Ny
Populär
|


 Låt oss fylla ett stort kärl (500 ml rundbottnad kolv) med svaveloxid (iv) so2, placera brinnande svavelbitar i det en stund eller tillföra gas från apparaten där det bildas. Svaveloxid (iv) kan också framställas relativt enkelt genom att droppa koncentrerad svavelsyra i en koncentrerad lösning av natriumsulfit na2so3. I det här fallet kommer svavelsyra, som är starkare, att tränga undan den svaga syran från dess salter.
Låt oss fylla ett stort kärl (500 ml rundbottnad kolv) med svaveloxid (iv) so2, placera brinnande svavelbitar i det en stund eller tillföra gas från apparaten där det bildas. Svaveloxid (iv) kan också framställas relativt enkelt genom att droppa koncentrerad svavelsyra i en koncentrerad lösning av natriumsulfit na2so3. I det här fallet kommer svavelsyra, som är starkare, att tränga undan den svaga syran från dess salter. Olika ostar används i tillverkningen av svavelsyra.Rent svavel började användas först på 60-talet. I de flesta fall producerar företag svaveloxid (iv) genom att rosta sulfidmalmer. I en roterande rörugn eller flerdäcksugn reagerar pyrit med atmosfäriskt syre enligt följande ekvation:
Olika ostar används i tillverkningen av svavelsyra.Rent svavel började användas först på 60-talet. I de flesta fall producerar företag svaveloxid (iv) genom att rosta sulfidmalmer. I en roterande rörugn eller flerdäcksugn reagerar pyrit med atmosfäriskt syre enligt följande ekvation: Metoder för att framställa svavelsyra från anhydrit kommer att vara viktiga även i framtiden, eftersom svavelsyra är den vanligaste kemiska produkten. Sulfater kan sönderdelas med höga (upp till 2000 °C) temperaturer. Müller fann att nedbrytningstemperaturen för kalciumsulfat kunde sänkas till 1200 °C genom att tillsätta finmalen koks. För det första, vid 900 °C, reducerar koks kalciumsulfat till sulfid, som i sin tur, vid en temperatur på 1200 °C, reagerar med oupplöst sulfat; i detta fall bildas svaveloxid (iv) och bränd kalk:
Metoder för att framställa svavelsyra från anhydrit kommer att vara viktiga även i framtiden, eftersom svavelsyra är den vanligaste kemiska produkten. Sulfater kan sönderdelas med höga (upp till 2000 °C) temperaturer. Müller fann att nedbrytningstemperaturen för kalciumsulfat kunde sänkas till 1200 °C genom att tillsätta finmalen koks. För det första, vid 900 °C, reducerar koks kalciumsulfat till sulfid, som i sin tur, vid en temperatur på 1200 °C, reagerar med oupplöst sulfat; i detta fall bildas svaveloxid (iv) och bränd kalk: